

RNA干扰(RNAi)是一项诺贝尔奖获奖技术,自1998年被发现以来,因其能够介导特定目标基因的敲除,为生物学的进步做出了重大贡献。人们一直在探索RNAi在医学和农业方面的应用,但成功与否参差不齐。过去25年对RNAi的研究使我们对其作用机制、靶标特异性以及动物和植物间不同效率的认识取得了进展。RNAi在昆虫生物学的进步中发挥了重要作用。RNAi技术是否完全符合昆虫害虫和病媒管理的期望?本综述将讨论RNAi机制的最新进展及其对昆虫科学的贡献。尚存的挑战,包括向目标位点的传递、效率差异、潜在抗性发展以及在昆虫管理中广泛使用该技术的可能解决方案。
1 简介
由Argonaute(Ago)家族蛋白和小RNA(如小干扰RNA(siRNA)和microRNA(miRNA))组成的复合物对mRNA的转录、稳定性和翻译进行靶向特异性干扰,从而导致基因产物及其功能水平下降的现象被称为RNA干扰(RNAi)。经过25年对方法开发、作用机制以及在动物、人类和植物中的应用开发的研究,RNAi在基础研究和应用研究中得到了广泛应用。RNAi方法极大地推动了生物学各个领域的进步。基于RNAi的疗法已经开发出来,并正用于治疗人类疾病。此外,基于RNAi的方法还被开发用于病虫害控制和农业作物改良。2002年,《科学》杂志宣布RNAi为年度十大进展技术。2006年诺贝尔医学奖授予了发现RNAi的Fire和Mello。自发现以来,RNAi在昆虫科学进步中发挥了重要作用。对昆虫RNAi的最初研究是在模式昆虫黑腹果蝇中进行的。在接下来的几年中,许多昆虫物种都发现了RNAi的功能,包括一些具有重要经济价值的昆虫,如害虫、病媒和益虫。RNAi在甲虫等一些昆虫类群中有效,但在飞蛾和蝴蝶等其他昆虫中却效率低下。RNAi在不同害虫中的不同效率以及对RNAi可能产生的抗性是RNAi在昆虫害虫和病媒管理中广泛应用的一些主要障碍。有关RNAi的评论文章很多,该综述将重点讨论对RNAi在过去25年中所做贡献的批判性评估,以及广泛使用该技术管理病虫害媒介等所面临的挑战和可能的解决方案。
2 RNAi的发现
基因沉默研究始于在矮牵牛植物中发现的一种意想不到的表型。将一种增强紫色酶的编码基因导入矮牵牛植株后,转基因植株的紫色呈现出减少而不是增加的趋势。进一步的研究发现,参与紫色产生的酶的内源编码基因被共抑制。据报道,在植物和动物的病毒抗性中,内源基因被共抑制。将La Crosse (La)病毒基因引入感染性Sindbis病毒表达载体,对其复制造成干扰。此外,病毒基因的表达干扰了加州血清群病毒在蚊子细胞和蚊子中的复制。在真菌Nuerospora crassa中也报道了基因沉默。但在这些研究中,沉默的触发因素和沉默的机制尚未确定。1998年,Fire和Mello在RNAi领域发表了一篇具有里程碑意义的文章,首次确定了双链RNA(dsRNA)是触发RNA沉默的分子,并创造了RNA干扰(RNAi)一词。本文还报道了dsRNA实现靶基因沉默的作用机制。随后几年的研究报道了RNAi在线虫、昆虫、植物和锥虫中的应用。2001年和2002年分别在哺乳动物细胞和小鼠中报道了RNAi的功能。在过去的25年里,对RNAi的研究导致了在医学和农业上许多应用的发展。
3 昆虫中的RNAi
第1个证明RNAi功能的昆虫是果蝇(Drosophila melanogaster)。利用果蝇遗传学和基因组学工具,用来研究转基因果蝇基因的功能。Drosophila stock centers可提供表达果蝇基因组中几乎所有基因的RNAi触发器的转基因蝇系。这些UAS转基因果蝇可以以组织和阶段特异性的方式与表达GAL4的GAL4系杂交,允许在特定组织和阶段敲低靶基因。将RNAi添加到果蝇工具箱中,彻底改变了这种模式昆虫的功能基因组学,促进了对涉及昆虫生命几乎各个方面的基因功能的研究。利用果蝇细胞系和转基因果蝇开发了高通量筛选试验,用于鉴定果蝇发育和生理过程中的基因及其功能。在接下来的几年里,RNAi在冈比亚按蚊Anopheles gambiae、赤拟谷盗Tribolium castaneum、斯氏按蚊Anopheles stephensi、德国小蠊Blattella germanica、烟草天蛾Manduca sexta、蜜蜂Apis mellifera、埃及伊蚊Aedes aegypti、沙漠蝗虫Locusta migratoria、马铃薯甲虫Leptinotarsa decemliata和褐飞虱Nilaparvata lugens等其他昆虫中得到了证实。
4 RNAi机制
细胞质中的双链RNA被dicer酶识别并剪切成18-21碱基对长度的小干扰RNA(siRNA)。含有argonaute蛋白的RNA诱导沉默复合体(RISC)促进siRNA与互补DNA/mRNA结合,阻断复制、转录和翻译。这导致目标基因产物水平降低,从而导致目标基因功能的敲低或敲除效应。在哺乳动物细胞中,dsRNAs诱导干扰素应答。大多数参与RNAi反应的关键参与者,包括dicers和argonautes,在昆虫中都是保守的。然而,参与dsRNA摄取和转运到细胞质中的蛋白质在昆虫物种之间是不同的,这导致了昆虫物种之间RNAi反应的差异(在第6节对此有更多的讨论)。然而,昆虫细胞中的干扰素反应并不强烈。因此,长dsRNAs可以作为昆虫的RNAi触发器。外源施加的dsRNA被昆虫细胞加工成多个siRNA,而不需要对脊椎动物中有效沉默靶基因所需的每个基因的siRNA进行优化。长dsRNAs(200~400 bp)被体外递送到昆虫细胞系或注射到昆虫体内以诱导RNAi应答。这使得在没有生物信息学工具的情况下更容易在实验室中实施RNAi技术。这可能是RNAi在全世界昆虫学实验室广泛应用的原因之一。RNAi技术促进了我们对害虫生物学、杀虫剂靶点和杀虫剂抗性发展的了解。在过去的25年里,如果没有RNAi技术的使用,大多数对非模式昆虫的研究是不可能的。
5 RNAi在基础科学和害虫防治中的应用
RNAi对昆虫生物学的理解做出了重大贡献。遗传学和基因组学工具的结合以及果蝇、家蚕和赤拟谷盗等模式昆虫基因组序列的可用性促进了功能基因组学的研究,以确定与昆虫发育、繁殖和行为有关的基因的功能。RNAi在推进非模式昆虫(包括害虫、病媒和益虫)的生物学研究中也发挥了重要作用。RNAi方法的应用有助于昆虫对杀虫剂靶点的鉴定和表征、杀虫剂的作用方式以及对杀虫剂的抗性发展。在RNAi的帮助下,对破坏性害虫(如褐飞虱、蝗虫)和病媒昆虫(如黄热病蚊子)的功能基因组学研究提高了我们对这些昆虫的发育、繁殖和免疫反应的认识。
RNAi在赤拟谷盗中发挥了良好的作用,并被广泛用于研究与生长、发育、繁殖和杀虫剂抗性相关的基因功能。西部玉米根虫Diabrotica virgifera是另一种利用RNAi识别杀虫剂靶点的鞘翅目昆虫。
植物中RNAi触发器的表达导致以转基因植物为食的昆虫的靶基因被敲低,从而导致昆虫死亡。这些结果显示了RNAi技术在病虫害管理方面的潜力,并吸引了公共和私营部门的投资,用于开发基于RNAi的病虫害控制方法。RNAi技术在保护作物和树木免受昆虫伤害方面的应用在多个系统中进行了测试,包括棉花、水稻、马铃薯、烟草、杨树和小麦。令人惊讶的是,植物介导的RNAi触发器的传递仅在少数作物害虫系统中进行了测试。为经济上重要的作物生产转基因植物的困难以及公众对转基因作物食品的犹豫接受可能是这一领域研究进展缓慢的原因。经过20多年的努力,只有一种植物介导的RNAi产品——玉米种子被商业化。
在诸如科罗拉多马铃薯甲虫、实蝇和甜菜夜蛾这样的昆虫中,喂食细菌中产生的dsRNA可诱导目标基因的有效敲除和死亡。据报道,酵母和藻类中产生的dsRNA也能触发蚊子体内的RNAi。体外合成的dsRNA还可以在鞘翅目昆虫如科罗拉多马铃薯甲虫和赤拟谷盗中诱导高效的RNAi,这些产品正在开发注册中,以控制这些害虫。RNAi还被用于保护有益昆虫免受病原体的侵害,例如感染蜜蜂的以色列急性麻痹病毒。人们开发了一种dsRNA产品Remebee-1来控制蜜蜂的这种疾病。转基因家蚕表达家蚕核多角病毒(BmNPV)lef-1基因的dsRNA,用于控制该病毒病。RNAi的另一个应用是阻止人类和植物病原体通过昆虫媒介传播。冈比亚按蚊成虫中靶向防御素基因的dsRNA降低了对革兰氏阳性细菌的抗菌防御。此外,冈比亚按蚊中补体样蛋白1(TEP1)基因的敲低,增加了敏感菌株中寄生虫的数量,但消除了耐药菌株的黑色耐药性。RNAi在理解蚊子的宿主-寄生虫相互作用和免疫反应中发挥了关键作用。
6 广泛使用dsRNA杀虫剂的障碍
经过25年对RNAi的研究,为什么我们只有少数基于RNAi的农药注册用于害虫管理?RNAi在昆虫中的不同效率及其在主要害虫中的较低效率,潜在的抗性发展以及公众对接受转基因作物食物的犹豫是RNAi在害虫管理中广泛应用的主要障碍。在发现RNAi在许多昆虫中的功能后,很明显,RNAi在测试的昆虫物种中以不同的效率起作用。在拟步甲科、金甲科和其他科的甲虫中,RNAi是有效和系统的。注射dsRNA可在半翅目昆虫中诱导高效的RNAi,如Oncopeltus fasciatus、Halyomorpha halys、Cimex lectularius以及其他目昆虫如B. germanica、S. gregaria和L. migratoria。相比之下,RNAi在大多数其他目昆虫(如鳞翅目)中是可变的和低效的。有趣的是,RNAi在半翅目叶蝉中效果良好,但在同目蚜虫中效果不佳。在大多数昆虫中,注射比喂食更能传递dsRNA。在果蝇中,发夹dsRNA的转基因表达比喂食或注射dsRNA更有效。在蝗虫和其他一些昆虫中,仅注射dsRNA触发RNAi;在这些昆虫中喂食dsRNA不会导致靶基因的敲低。RNAi效率在昆虫的不同组织和阶段也是可变的。RNAi效率还取决于靶基因及其表达水平。组成性和高表达的靶基因比低水平和受限制的发育阶段和组织表达的靶基因更有效地被敲除。这些结果表明,RNA在消化道中的降解、dsRNA被dicer酶递送到细胞质中消化和被RISC复合体募集,以及RNAi相关基因的表达水平可能在决定RNAi效率方面发挥重要作用。
dsRNA到达其作用位点的第1个障碍是双链核糖核酸酶(dsRNases)(图1)。在蝗虫中,注射而非口服dsRNA诱导RNAi。核酸酶对dsRNA的消化是导致RNAi效率低下的主要原因。沉默dsRNase基因可提高RNAi效率。dsRNase在Heliothis virescens(低效RNAi)中比在L. decemlineata中更活跃。添加到Sf9细胞培养基中的dsRNA被Sf9细胞分泌的dsRNase降解;沉默dsRNase可提高这些细胞中的RNAi效率。在鳞翅目中发现的RNAi效率相关核酸酶(Rease)被认为是导致这些昆虫中RNAi效率低下的主要因素。保护dsRNA免受核酸酶侵害的配方可能会提高对dsRNA有折射作用的昆虫的RNAi效率。
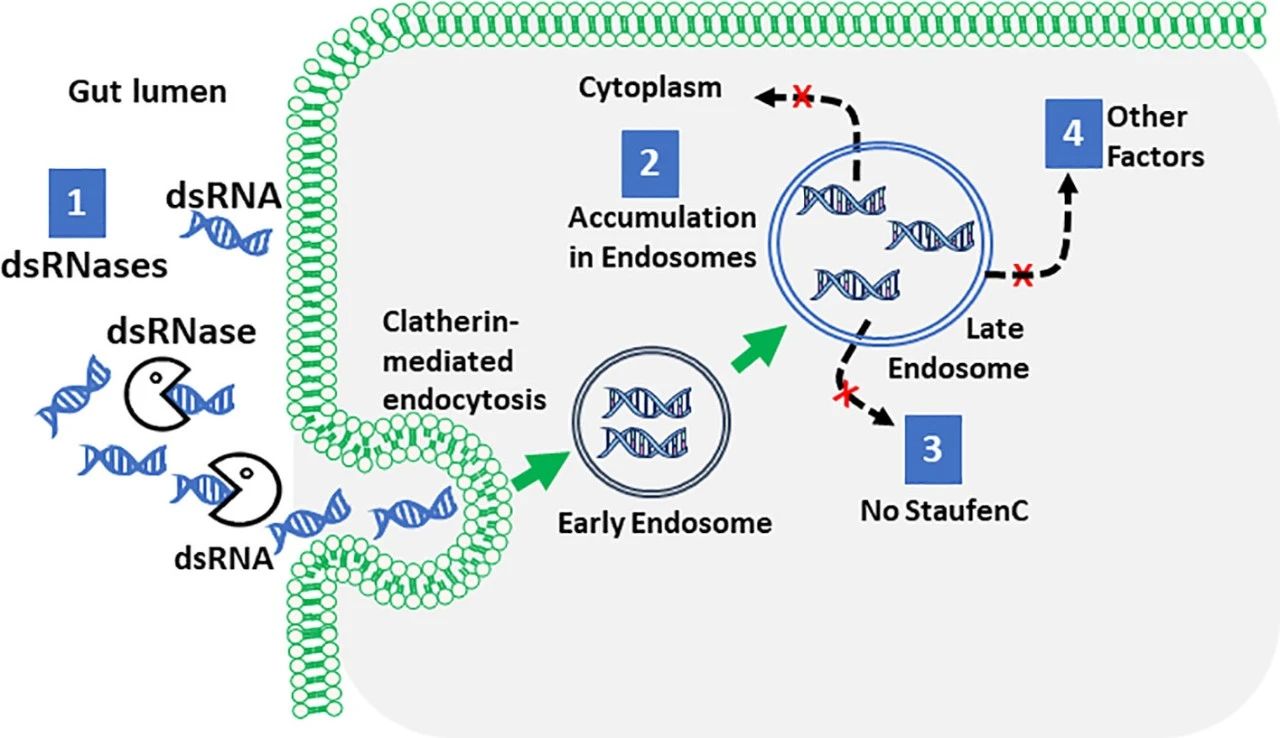
图1 影响昆虫RNAi效率的主要因素
dsRNA到达细胞质中的作用位点时遇到的第2个障碍是穿越细胞膜和细胞内运输(图1)。Clatherin介导的内吞作用被确定为dsRNA摄取的主要途径。巨胞饮被认为是Anthonomus grandis摄取dsRNA的主要途径。根据浓度和大小的不同,dsRNA可以通过多种机制进入细胞。在L. migratoria中,dsRNA不会在卵泡细胞和卵母细胞中诱导RNAi,因为这些组织不吸收dsRNA。在鞘翅目动物中,胞内运输可以有效地将dsRNA运送到细胞质中。相比之下,鳞翅目动物的细胞内运输效率低下,大部分dsRNA被困在核内体中。
参与dsRNA胞内转运及其加工成siRNA和募集到RISC复合体的关键参与者的表达水平差异影响RNAi的效率。在L. decemlineata和S. frugiperda之间检测到dsRNA加工成siRNA的差异。在鳞翅目、直翅目、半翅目和双翅目昆虫中,将dsRNA加工成siRNA的效率不如鞘翅目。Dicer酶的表达水平及其活性的差异可能导致dsRNA到siRNA加工的差异。鉴定出的Argonaut基因的数量,以及这些基因在siRNA、miRNA和piRNA通路中的参与程度,在昆虫中是不同的。在家蚕中转基因表达Ago2可提高RNAi的效率,这表明该蛋白可能是鳞翅目动物对RNAi反射的限制因素之一。
一种双链RNA结合蛋白(Staufen C)在鞘翅目、L. decemlineata和T. castaneum中被鉴定为高效RNAi的关键分子。有趣的是,这种基因只在鞘翅目昆虫中被发现,并且是这些昆虫将dsRNA加工成siRNA所必需的。L. decemlineata,通过暴露于dsRNA触发器选择的Lepd-SL1 RNAi抗性细胞比RNAi易感细胞表达更低水平的Staufen C。这些研究表明,Staufen C是高效RNAi合作蚁的关键参与者,也是对RNAi农药产生抗性的潜在靶点。最近的研究表明,Staufen C在D. melanogaster这样的鞘翅目动物中起作用,参与将dsRNA加工成siRNA。秀丽隐杆线虫需要系统性RNA干扰缺陷蛋白1(CeSid1)才能成功进行RNAi。CeSid1在昆虫细胞系中的表达提高了RNAi。然而,SID1同源物对RNAi功能的要求在不同的昆虫中有所不同。CeSid1在两种S. frugiperda细胞系(卵巢来源的Sf9和中肠来源的Sf17细胞)中的表达表明,CeSid1在Sf9细胞中提高了RNAi效率,而在Sf17细胞中没有提高。在表达CeSid1的Sf9细胞中,观察到dsRNA在晚期核内体中的积累减少,dsRNA加工成siRNA的过程增加。在表达cesid1的转基因昆虫中,Verson腺体的RNAi效率改善最大,而中肠的RNAi效率改善最少。这些数据表明了RNAi机制在不同细胞和组织类型之间的可变性。
7 提高RNAi在主要病虫害媒介中的效率的策略
将dsRNA递送到细胞质中的作用位点可能会提高RNAi在主要害虫和疾病媒介中对RNAi的效率。与任何其他杀虫剂活性成分一样,该配方是将dsRNA成功递送到作用部位的关键。为了提高RNAi效率,研究人员开发了几种材料来制备dsRNA(图2)。在蚊子、冈比亚按蚊、幼虫中,壳聚糖和dsRNA配方提高了RNAi效率。其他几种dsRNA的纳米配方,包括含胍聚合物、纳米载体/dsRNA/洗涤剂配方、胍基化聚合物和支链两亲肽双分子层共轭金纳米颗粒也被证明可以改善RNAi。dsRNA的纳米配方有助于保护dsRNA免受dsRNases的攻击,促进dsRNA穿透体壁,并改善dsRNA的细胞摄取和内体逃逸,最终导致RNAi效率的提高(图2)。具有部分封闭末端的短RNA(23 nt)(pcRNAs)被证明通过不依赖网格蛋白的途径进入细胞,并改善靶基因的敲除。pcRNA可能有助于克服dsRNA到达昆虫细胞质所面临的一些障碍,这些障碍对RNAi有抗性。在细菌、酵母、藻类、苏云金芽孢杆菌和植物病毒等微生物中表达的dsRNA被证明可以诱导昆虫在摄入这些表达dsRNA的微生物后敲低靶基因。植物介导的dsRNA传递是另一种选择。事实上,第1个RNAi商业产品就是基于这种方法:表达针对玉米根线虫SNF7基因的dsRNA的转基因玉米保护植物免受其伤害。dsRNA在植物内的表达已被证明可以保护作物免受害虫的侵害。
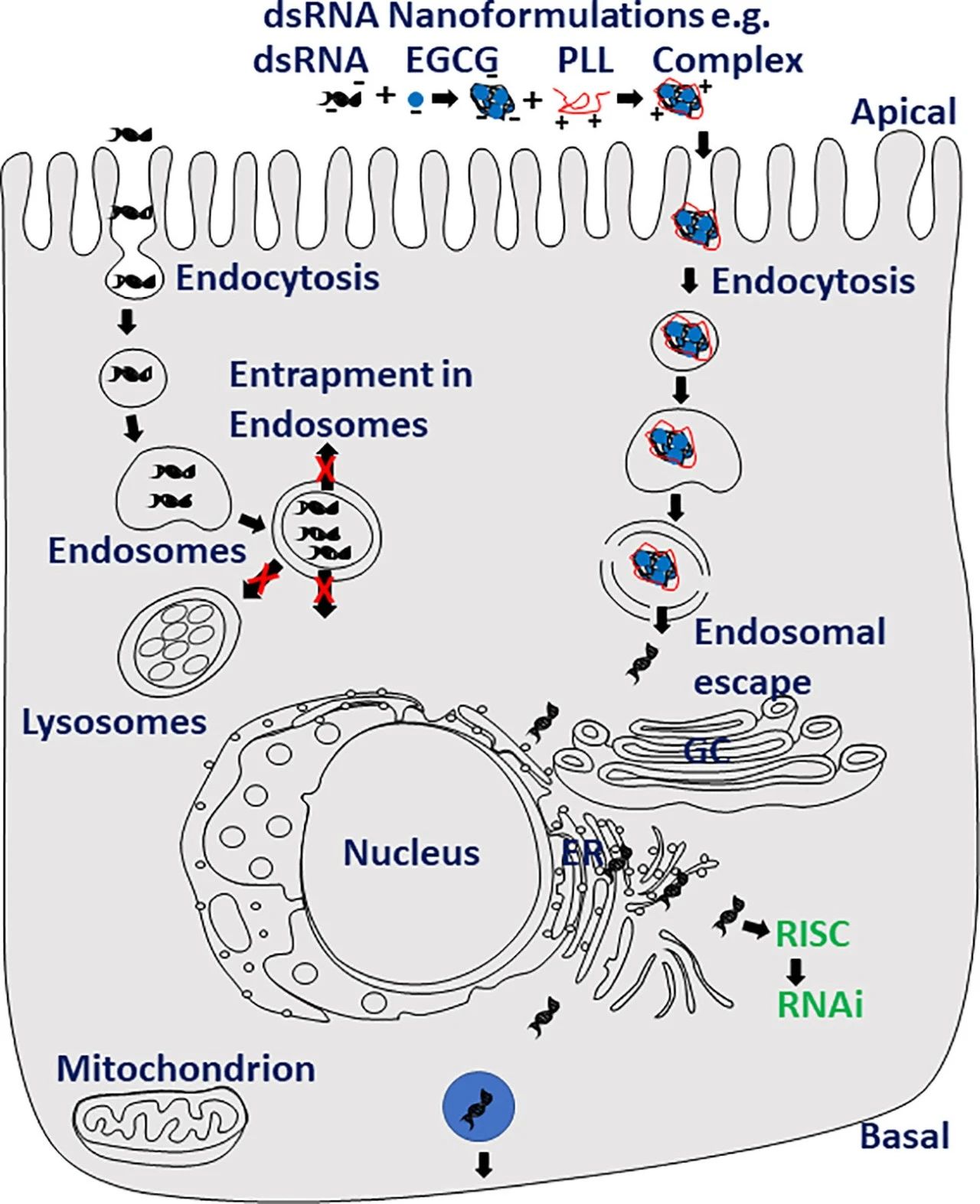
图2 纳米技术有助于提高主要害虫的RNAi效率
8 结论和未来展望
在过去的25年里,RNAi对我们了解昆虫的结构和功能做出了无可辩驳的贡献。然而,在开发害虫和疾病媒介控制的RNAi方法方面的进展并不那么令人鼓舞;只有一个商业产品和一些额外的产品正在筹备中。RNAi技术在昆虫防治中广泛应用的主要障碍之一是其在主要害虫和媒介昆虫中的效率差异。此外,表达苏云金芽孢杆菌毒素的转基因作物对鳞翅目害虫有效,而对主要刺吸昆虫的RNAi效率低下,这延缓了基于RNAi的产品的发展。害虫对RNAi产品的潜在抗性发展也是一个主要问题。纳米dsRNA可以帮助将dsRNA运送到作用位点,提高RNAi的效率。通过微生物生产和传递dsRNA的方法取得了令人鼓舞的进展。未来25年对RNAi的研究有可能找到解决这些问题的方法,并促进该技术在昆虫防治等领域的广泛应用。
原文链接:https://doi.org/10.3389/finsc.2023.1209478。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。