
0 引言
RNA干扰(RNA interference,缩写为RNAi)是指由RNA(细胞内源或外源)诱发的基因沉默现象,其机制是短的反义RNA通过阻碍与其有互补序列基因的转录或翻译来抑制基因的表达。近年来,基于RNAi机制的有害生物防治策略发展迅速,用于防治有害生物的RNA分子制剂被称为核酸农药。相比于传统的小分子农药,核酸农药靶标特异性强,无残留,且开发成本远低于化学农药,符合当今社会对于环境友好型农药的要求。2018年,美国食品药品监督管理局批准了第1个基于RNAi的药物——ONPATTRO,该药物可治疗伴有多发性神经疾病的遗传性转甲状腺素蛋白淀粉样变性(hATTR),这标志着RNAi技术的应用进入一个新时代。在农业领域,首个在美国国家环境保护署(EPA)获批的核酸农药产品是表达DvSnf7双链RNA的转基因玉米,用以防治西方玉米根虫Diabrotica virgifera LeConte(western corn rootworm,WCR),该产品计划于2024上市(https://traits.bayer.com/corn/Pages/SmartStax-PRO.aspx)。近期,拜耳集团采用RNAi技术生产的VT4PRO™玉米也获得了EPA的商业登记,最早将于2024年在美国上市。虽然RNAi防治有害生物的技术正处于商业开发的热点阶段,但若实现其大规模应用还需要解决一些阻碍,例如RNA递送至靶细胞的效率问题、靶标基因的沉默效率问题、剂量限制性毒性和干扰效率不足以及RNA分子的稳定性和持效性等。就防治病原微生物的核酸杀菌剂而言,虽然已有文章报道在实验室条件下,体外或体内应用合成的长双链RNA(double-stranded RNA, dsRNA)或小干扰RNA(small interfering RNA, siRNA)可以下调微生物中靶标必须基因的表达,从而实现防控卵菌、真菌和病毒病原体,但是其防治效果与稳定性方面表现得较为复杂。本文拟从RNAi的发展历程中探寻那些改变核酸杀菌剂发展方向的重要事件,从理论与技术角度分析核酸杀菌剂目前存在的问题与障碍,通过比较化学杀菌剂与核酸杀菌剂的优缺点阐述核酸杀菌剂的发展对化学杀菌剂市场的影响。
1 RNAi研究的发展历程
RNAi现象是Fire等在对秀丽隐杆线虫Caenorhabditis elegans的研究中发现并揭示的。该生物现象的发现解释了之前在植物、真菌和动物中观察到的令人困惑的基因沉默现象。随后,RNAi现象被证实在多种生物中广泛存在,但是不同物种间RNAi核心元件的起源和生物合成存在较大差异,这引发了科研人员的研究兴趣。目前人们普遍认为19~30 nt的非编码小RNA(small RNAs, sRNAs)在RNAi过程中发挥着重要作用。sRNAs根据来源、结构和生物作用可分为3类:小干扰RNAs(siRNAs)、微小RNAs(microRNAs,miRNAs)和piwiRNAs(piwi-interacting RNAs,piRNAs)。大多数真菌的sRNAs为siRNAs。生物体内的RNAi过程大致可分为起始、效应和级联放大3部分。2001年,科研工作者发现Dicer酶是RNAi起始步骤的关键酶,Dicer将长dsRNA剪切加工为成熟的siRNA;然后,siRNA单链被加载到具有核酸内切活性的Argonaute蛋白上,形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)。siRNA与互补的信使RNA(messenger RNA, mRNA)结合后,靶标mRNA会被Argonaute直接剪切或介导RISC对mRNA的翻译抑制。研究者随后发现,RNA依赖性RNA聚合酶(RNA-dependent RNA Polymerase,RdRP)参与次级小RNA的产生与复制,进一步增强和放大了沉默效应。在植物和秀丽隐杆线虫C. elegans中,RdRP可在靶RNA模板上形成合成sRNA或dsRNA的扩增环,起到级联放大的作用。随着研究的逐渐深入,RNAi成为哺乳动物、植物、线虫、真菌和卵菌基因功能研究的重要工具。RNA在生物体内有效的传递与运输是RNAi应用于医药和农业领域的前提。大量研究表明,sRNA可以在相互作用的生物体内传递(例如植物-真菌),进而诱导彼此的基因沉默,该机制被称为跨界RNA干扰。dsRNA或sRNA只有进入细胞中才能发挥出高效的沉默效率,不同生物对dsRNA或sRNA的摄取机制存在差异。在秀丽隐杆线虫C. elegans中,dsRNA的吸收主要是通过SID跨膜蛋白家族。SID-2基因编码一种跨膜蛋白,通过内吞作用十分缓慢地摄取dsRNA,而SID-1基因产物与内吞作用无关,主要参与质膜中快速转运和通道的形成。昆虫细胞摄取dsRNA的机制现已基本确定为网格蛋白依赖性内吞作用。棉铃象鼻虫Anthonomus grandis中dsRNA的细胞摄取与大胞饮作用相关。到目前为止,虽然有文章报道网格蛋白介导的内吞作用参与了核盘菌对dsRNA的摄取,但真菌吸收dsRNA或sRNA的具体机制仍不清楚。这也限制了核酸农药在真菌防控方面的发展。
RNAi药物首先在医药领域得到发展。2003年,siRNA首次作为药物应用于哺乳动物,其治疗潜力一度成为多家公司的研究热点。然而,首批siRNAs临床试验RNAi效果不显著并伴随不确定的干扰效应,试验中也出现了与免疫相关的毒性,最终以失败告终;随后第2波的临床试验研究发现,系统应用siRNA纳米制剂能对人体产生效果,但是药效一般,同时表现出明显的剂量限制性毒性和疗效不足的问题。鉴于RNAi药物的负面作用,21世纪10年代初大型制药公司退出了RNAi药物研究领域,这对该行业造成极大的打击。但是,一些较小的RNAi药物公司和科研人员一直坚持改进siRNA的递送、序列选择、化学配方和输送机制等技术,并取得了一定的进展。2018年,RNAi药物ONPATTRO(patisiran)得到美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)的批准,该类新siRNA药物主要用于治疗遗传性转甲状腺素淀粉样变性病。最近,FDA和EMA批准吉夫拉里(Givlaari®)作为第2个RNAi药物用于治疗急性肝卟啉症(AHP)成人患者。多种适用于肝脏、肾脏和眼部疾病的候选药物正处于Ⅰ、Ⅱ和Ⅲ期临床试验中,RNAi医药重新成为研究焦点。
基因工程(genetic engineering,GE)的迅速发展使得RNAi相关药品在农业领域中发展迅速,核酸农药应运而生。针对有害生物的RNAi技术可以通过不同的方式实现,包括通过宿主诱导的基因沉默(host-induced genesilencing,HIGS)、喷雾诱导的基因沉默(spray-induced gene silencing,SIGS)以及病毒诱导的基因沉默(virus-induced gene silencing,VIGS)。农业领域首个商业化RNAi产品是可以表达dsRNA的转基因玉米,通过表达靶向Snf7基因的发夹dsRNA来控制西方玉米根虫。该商品于2017年获得EPA批准,已经以商品名SmartStax Pro在2022年上市(https://traits.bayer.com/corn/Pages/SmartStax-PRO.aspx)。除此之外,一种靶向蛋白酶体亚基β5编码基因(PSMB5)的长链dsRNA生物农药活性成分,名为Ledprona,即将获得美国EPA登记。
2 核酸杀菌剂在植物病害防控中的应用与瓶颈
在RNAi被用于病害防控的最初阶段,RNAi对病毒性病害的防控是众多研究者探究的热点内容。科研人员分别开发了4类基于RNAi的抗病毒技术:正义链诱导的转录后基因沉默(S-PTGS)、发夹RNA诱导的PTGS(hp-PTGS)、人工miRNA诱导的PTGS(AMIR)和反式作用siRNA诱导的PTGS(TAS)。利用上述技术培育了可以表达sRNA的转基因植株,并分别在实验室和田间条件下进行了测试,发现部分转基因植物获得了对病毒的持久抗性。据国际农业生物技术应用收购服务(ISAAA)网站报道,数十种使用RNAi基因工程开发的抗病毒转基因作物已获准商业发行(http://www.isaaa.org/)。
在过去10年中,已有成功应用RNAi控制病原真菌和卵菌的报道。2010年,研究人员首次通过在转基因烟草植株中表达dsRNA,成功沉默轮枝镰刀菌Fusarium verticillioides转基因菌株的β-glucuronidase(GUS)报告基因。随后,有文章报道,在应用HIGS技术生产的转基因小麦、大麦和拟南芥中小麦白粉病菌Blumeria graminis和禾谷镰刀菌Fusarium graminearum的侵染速度变慢,采用同样的方法还可抑制尖孢镰刀菌Fusarium oxysporum对香蕉的侵染。在疫霉的RNAi研究中,转基因dsRNA序列的稳定表达成功沉默了致病疫霉Phytophthora infestans和寄生疫霉Phytophthora parasitic的靶基因。但是,也有RNAi未起作用的报道,在表达PnPMA1 dsRNA的转基因拟南芥中,HIGS介导的寄生疫霉沉默未能成功启动。
由于转基因植株培育时间较长,不需培育转基因植株的喷雾诱导基因沉默(SIGS)逐渐步入人们视野。随后,SIGS被证明可有效防治禾谷镰刀菌F. graminearum、灰霉病菌Botrytis cinerea和油菜菌核病菌Sclerotinia sclerotiorum等。研究发现,外源喷施dsRNA对于防治灰霉病菌、菌核病菌、立枯丝核菌Rhizoctonia solani、黑曲霉Aspergillus niger和大丽轮枝菌Verticillium dahliae效果较好,但对于卵菌(如致病疫霉)效果一般。dsRNA可以通过根或树干进入植物维管系统(木质部和韧皮部),但其通过不同植物组织的吸收效率不同。南京农业大学杀菌剂生物学团队证明了小麦胚芽鞘完整表面较难吸收dsRNA,而创面则能有效吸收dsRNA。
尽管有关RNAi技术的基础研究热度不断提升,但是其大规模应用仍有很多需要克服的难关。常见的阻碍有脱靶效应、RNA分子的稳定性和成本等。本文将着重分析影响RNAi效率的因素,虽然这些观点与前人的观点存在些许差异,但是可以解释RNAi杀菌剂商业化难的原因。由于作用机制不同,我们将分开讨论HIGS和SIGS中RNAi效率影响因素。
首先介绍HIGS中RNAi效率的影响因素。HIGS中,RNA分子是由转基因植株产生的,因此其siRNA浓度是由植物RNAi系统相关酶及dsRNA的表达程度决定的。许多因素可以影响植物中dsRNA的表达,如启动子强度、dsRNA的长度和结构以及植物基因组的特征。在大多数研究中,科研工作者采用组成型强启动子转录dsRNA,并利用内含子间隔正义和反义RNA序列,形成发卡结构RNA(HairpinRNA, hpRNA),以期高效表达dsRNA。然而,有研究发现,这种传统的hpRNA设计会造成dsRNA转录的自沉默,而用胸腺嘧啶替代胞嘧啶可以防止自沉默,且不影响hpRNA的形成,达到高效沉默的目的。值得注意的是,不同真核生物的Dicer蛋白家族在结构域的结构和分子功能上表现出明显的多样性。不同物种中的Dicer和DCL(Dicer-like protein)在RNA靶标偏好、siRNA产物长度和特定相互作用对象方面也存在差异。因此,尽管dsRNA相同,植物细胞与真菌细胞体内切割产生的siRNA却不同。所以,当植物产生的siRNA被真菌吸收并利用真菌Argonaute蛋白诱导RNA沉默时,RNAi效率可能会降低(图1)。有报道称,靶向相同基因的dsRNA和siRNA都可以降低基因表达,但在赤拟谷盗Tribolium castaneum Herbs中,只有使用dsRNA才能观察到RNAi介导的表型变化。事实上,高浓度siRNA并不代表拥有高效率RNAi。这是因为HIGS的触发主要决定于siRNA的吸收浓度。虽然植物可以通过细胞外囊泡向病原真菌运送sRNA,但除此之外,真菌中的RNAi效率还会受到siRNA特性的影响。研究者发现,由于植物质体中不存在RNAi,因此在植物质体中表达dsRNA可以排除植物RNA干扰相关元件对dsRNA的切割,从而避免与不同物种间RNAi的差异性,这或许可以解决由siRNA差异导致的RNAi效率差的问题。除了技术因素之外,基于HIGS的转基因作物产业化还受到国家政策的限制。HIGS类转基因作物在抗虫、抗病上存在较大优势,但也存在一些隐患,例如基因漂流、基因污染、抗生素标记基因转移等。因此,我国对转基因作物产业化十分谨慎,并制定了相关转基因法律法规和管理规范进行风险控制。
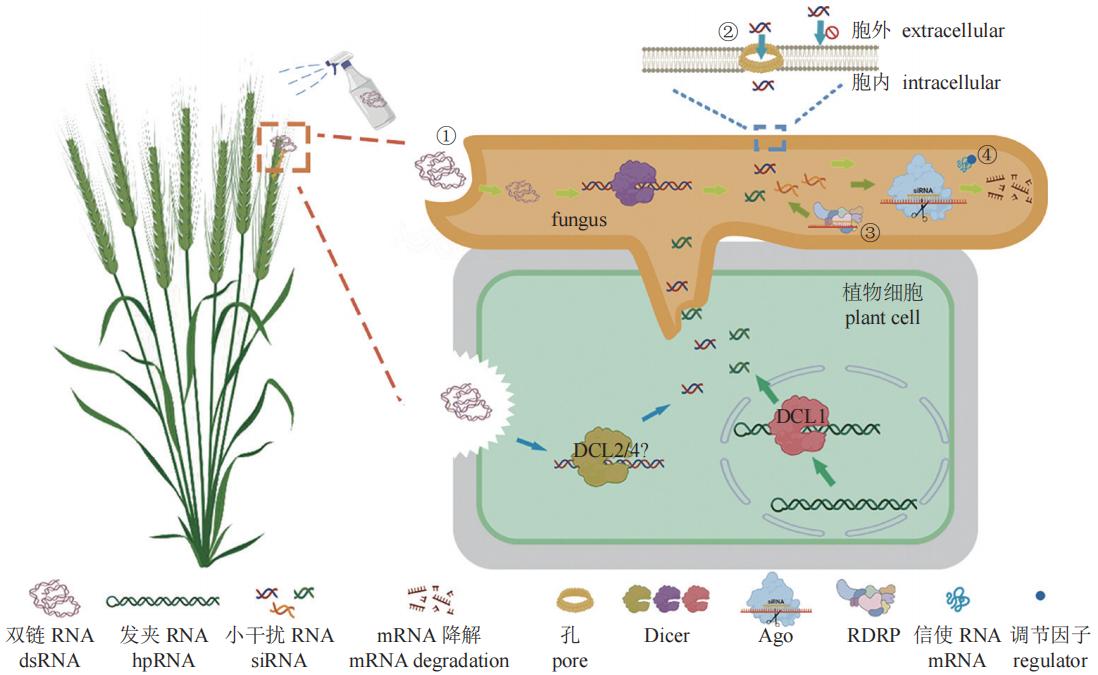
图1 影响RNAi效率的因素
注:宿主诱导的基因沉默(HIGS)中,植物细胞核中产生发夹(hpRNA),经DCL1切割后产生siRNA,siRNA进入真菌细胞后发挥作用。喷雾诱导基因沉默(SIGS)中,一部分的dsRNA进入植物细胞中,经DCL2/4(具体机制未知)切割后产生siRNA,siRNA同样进入真菌细胞中发挥作用;另一部分的dsRNA经胞吞作用直接进入真菌细胞中,经Dicer切割后产生siRNA,siRNA与互补的mRNA结合后,靶标mRNA会被沉默复合体(RISC)剪切,最终mRNA降解。影响RNAi效率的主要因素:① 真菌菌丝主要通过菌丝顶端的内吞作用摄取dsRNA,摄取效率有限;② siRNAs分子量较大,不可直接通过细胞壁细胞,可能通过细胞壁上的孔隙进入胞内,效率低;③ RNA依赖性RNA聚合酶(RdRP)参与次级小RNA的产生与复制,进一步增强和放大沉默效应。不同生物中RdRP扩增效率相差较大;④ 真菌中存在其它可以影响RNAi效果稳定性的调节因子。
最新研究表明,SIGS中RNAi效率影响因素比HIGS中更复杂。喷施在植物表面的dsRNA分为直接和间接两种方式进入真菌体内:直接途径为RNA直接被真菌细胞吸收;间接途径为RNA首先被植物细胞吸收,然后运输到真菌细胞中。不同途径吸收的RNA以不同的机制发挥作用,真菌细胞直接吸收的RNA直接引发了真菌RNAi机制;而植物细胞吸收的RNA先引发了植物RNAi机制,进而引发了真菌的RNAi机制(图1)。如前文所述,喷洒在胚芽鞘完整表面的dsRNA不能被胚芽鞘吸收,而可能是直接被真菌细胞吸收。因此,dsRNA只可在短时间内发挥作用,并不能提高植物的抗病能力。南京农业大学杀菌剂生物学团队发现亚洲镰刀菌F. asiaticum中由dsRNA引发的RNAi效应仅可持续约9 h,这是因为亚洲镰刀菌无法扩增产生次级siRNA。siRNA在生物体内的二次扩增与RdRP直接相关,RdRP通过将单链RNA转化为dsRNA或合成siRNA来进一步增强和放大RNAi效果。迄今为止发现的所有RdRP都是从一个祖先RdRP进化而来,在植物、真菌和部分动物中发现了许多同源物。在许多后生动物中也发现了RdRP的同源物,比如线虫纲(秀丽隐杆线虫)、刺胞动物门(水螅Hydra)、螯肢动物亚门(蜱Tick)、半索动物门(囊舌虫Acornworm)、尾索动物亚门(海鞘Seasquirt);但在其他类群中,例如扁形动物门(涡虫Planaria)、六足亚门(果蝇Drosophila)或脊椎动物门(脊椎动物Vertebrates)等基因组中却无发现。有趣的是,禾谷镰刀菌F. graminearum中至少存在5个RdRP,但其siRNA的二次扩增并不充分。此外,dsRNA的递送效率和稳定性同样影响RNAi效率,这是因为dsRNA在递送至靶标生物的过程中十分容易受到酶或pH值等因素的影响而降解。为了解决此类问题,科研人员将核酸序列包埋在特定的材料中,形成核酸-材料复合体,不仅成功提高了核酸稳定性、增加了递送效率,有些材料还可以起到增效的作用。目前常见的包被系统为脂质体、病毒样颗粒、复合纳米颗粒和生物粘土,根据待递送的RNA类型、靶生物及其摄取机制选取合适的包被系统。
从上文中我们不难看出,HIGS和SIGS最终的关键步骤均为诱导真菌细胞的基因沉默。但是,dsRNA或sRNA分子进入真菌时会被细胞壁和细胞膜阻隔。真菌细胞壁在真菌与环境的相互作用中发挥着重要作用。真菌细胞壁结构比较复杂,通常由几丁质、β-1,3-和β-1,6-葡聚糖、甘露聚糖和蛋白质组成,不同真菌细胞壁组成成分差异较大。以酿酒酵母Saccharomyces cerevisiae为例,甘露糖蛋白是酵母细胞壁的重要组成成分,决定了细胞壁的孔隙度,研究表明,在分子自然折叠的情况下,酵母细胞壁可阻挡大于600 Da的分子进入。20-nt siRNA的分子质量约为6,569 Da,在自然折叠的情况下,分子粒径远大于细胞壁的孔隙度。这也就意味着,dsRNA或sRNA很难通过正常的细胞壁表面进入细胞内。之前的研究表明,除非使用转化技术,如原生质体介导的转化、农杆菌介导的转化、电穿孔、生物方法和冲击波介导的转化,否则几乎不可能将遗传信息(质粒或基因)运输到真菌细胞中。但是,这并不意味着sRNA或dsRNA绝对不能穿过细胞壁。研究表明,酿酒酵母表面分布有直径在50~250 nm之间的孔隙。351个核苷酸的RNA平均截面长度为(43.6±4.6)nm,头部直径测量为(17.0±3.6)nm。如此看来,短一些的dsRNA和sRNA有可能通过孔隙进入真菌细胞(图1),但是据我们观察这个效率极低。
在许多真核生物中,胞吞作用也参与了dsRNA的摄取。最近的研究证实,核盘菌中dsRNA的摄取是通过网格蛋白介导的内吞作用发生的。内吞作用是生物体内重要的生物活动,指的是通过质膜的变形运动将细胞外物质转运入细胞内的过程。强有力的证据表明,内吞作用在菌丝顶端占主导地位,在快速生长的菌丝中,肌动蛋白斑块集中在菌丝顶端,形成一个顶端下环,与分泌为主的尖端空间耦合。因此,快速延伸的菌丝顶端具有更有效的内吞作用。我们的研究结果与上述理论一致,Myo5-8 dsRNA诱导的表型出现在亚洲镰刀菌和禾谷镰刀菌菌丝顶端。据报道,RNAi信号可以在植物不同细胞间转移,但在禾谷镰刀菌中,大多数RNAi相关表型仍表现在顶端细胞中。
除此之外,真菌中还存在其他可以影响RNAi效率的因素。之前的研究表明,将dsRNA负载于纳米颗粒上可提高其稳定性和效果。但是,增强dsRNA的稳定性并不能完全提高RNAi效率的稳定性,这是因为还存在另外可以降低RNAi效率的复杂机制。在这里,我们讨论的RNAi效率的稳定性并不是指体外合成的dsRNA或sRNA分子的稳定性,而是体内RNA干扰效率的稳定性,即对靶基因的沉默效率稳定性。RNAi效率受多种因素影响,同一物种的不同转录本及基因型、同一转录本的不同区域,甚至是观察表型效果的不同时间都有可能观察到不同的RNAi效率。在精心控制试验变量的条件下,经常会得到重复率低甚至前后矛盾的结果。研究发现,靶标mRNA的表达调控、靶标mRNA的二级结构、sRNAs的数量与序列特异性,以及dsRNA效应因子等因素都可以影响RNAi效率。首先,不同的mRNA在丰度、表达时间和空间上存在显著差异。不难想象,如果靶标mRNA表达高且易变,那么它就不容易被沉默。对鳞翅目昆虫的RNAi试验分析显示,在130个被测试的基因中,高水平沉默的占38%,低水平沉默的占14%,完全没有沉默的占48%。其次,基因沉默效率与靶标位点局部的mRNA结构呈负相关,该结构可以通过氢键(H-b)指数(结构因子的单一参数)来表征。这也就解释了为什么dsRNA或siRNA的基因沉默效率会因mRNA的靶向位置而产生巨大的差异。有趣的是,所有关于dsRNA位置效应的报道都有一个共同点——没有在dsRNA同源区域之外发现siRNA。再者,有效切割的必备条件为碱基配对序列的中间序列完全互补(种子序列),只有完全互补才能被PIWI域切割。这一点在同为小分子RNA的miRNA动力学研究中被证实。通过miRNA动力学分析可得出,低丰度的miRNA一般不能产生有生物学意义的调控,因为它们的浓度低于核心匹配靶点的解离常数(Kd值)(小鼠AGO2为3.7 pmol/L,果蝇AGO2为20 pmol/L)。最后,RNAi过程还受到其他因素的调控,如siRNA降解酶和RNAi调节因子ERI-1至ERI-9。到目前为止,尚不清楚调控RNAi效率变化的真正机制。
3 核酸杀菌剂对传统杀菌剂的影响
目前,生产中植物病原真菌的防治主要依靠化学杀菌剂,但因其使用时间长、使用范围广等,导致农药残留、抗药性等负面问题频发。基于RNAi的核酸农药特异性高、无残留,更符合当今社会对于环境友好农药的需求,因此成为潜在的新型绿色植保产品,引起了当前市场趋势的变化。
首先,核酸农药可以减少农药用量并可治理有害生物抗药性。核酸农药的应用可以降低田间化学农药的用量。由于广谱性化学农药大范围的频繁使用,导致有害生物抗药性问题频发,化学农药的防治效果不断下降。此外,抗药性问题还会引发突发性的防治失败,造成农产品产量下降甚至绝收,给农业生产和粮食安全带来严峻的挑战。由于作用机制不同,RNAi可以用来治理有害生物对化学农药的抗性问题。例如,通过Faβ2Tub-3 dsRNA沉默β2-tubulin可显著降低真菌对多菌灵的抗性。更令人惊讶的是,多菌灵延长了Faβ2Tub-3 dsRNA的持效时间。同样,应用dsRNA可以通过抑制镰刀菌靶基因Myosin 5(Myo5)的表达,降低亚洲镰孢菌的侵染以及对氰烯菌酯(杀真菌剂JS399-19)的抗性。还有另一个例子,RNAi能够治理田间种群对杀虫剂的抗性。西方玉米根虫是一种适应性强的入侵害虫,严重危害玉米,对几乎所有的化学杀虫剂都产生了抗药性。目前已成功开发培育出表达vATPaseA dsRNA的转基因玉米,可以有效控制西方玉米根虫。这种基于RNAi技术的产品已获得EPA批准。
然而,也要认识到核酸药剂同样存在抗药性风险。基于抗药性产生机制,结合RNAi的原理和特点,我们列出了3种可能影响RNAi效率的抗药性机制:(i)靶基因变异。RNAi基因的多态性和突变可导致dsRNA和mRNA序列的不匹配,从而产生抗药性。一个极端的例子是植物病原细菌和酿酒酵母S. cerevisiae,由于缺乏可识别的Argonaute、Dicer和RdRP同源物,对RNAi药剂存在天然抗性。此外,RNAi基因的表达变化(如StauC、V-ATPase B和VATPase d)也可以改变细胞对RNAi药剂的敏感性。(ii)靶标物种对dsRNA的吸收降低。最近的研究发现,不同真菌的RNA摄取效率不同。炭疽病菌Colletotrichum gloeosporioides不能吸收dsRNA,致病疫霉P. infestans不同细胞类型和发育阶段吸收效率也各有不同。(iii)RNAi效率的稳定性。如前文所述,RNAi表型变化频繁。在某些情况下,RNAi药剂对真菌的药效稳定性差。RNAi效率的不稳定性可能与已报道的RNAi元件无关,而与靶mRNA结构的调控有关。
其次,新型RNAi产品的开发速度要快于化学杀菌剂。与化学农药相比,RNAi的研制过程相对简单,研制成本较低。目前,因为新化学先导物的发现难度逐年增加,开发一种新型化学农药需要花费近12年的时间,且成本超过2.8亿美元。相比之下,在美国,开发RNAi药剂的成本为300万~700万美元,上市时间为18~24个月。与化学药剂相比,RNAi的候选物更易筛选。一旦该基因在真菌的生长、发育和致病性中起重要作用,靶向该基因的RNA分子就可能起到保护植物的作用。不过,RNA的合成成本高于化学杀虫剂。但是随着技术的发展,dsRNA的生产成本逐年降低,2008年的成本为1.25万美元/g,2018年已降至60美元/g。2020年,RNAGri(一家生物技术公司,前身为APSE)专注于吨量级dsRNA的生产与纯化,开发出一套由大肠杆菌生产APSE RNA容器(ARC)的系统,能够大量生产封装可直接喷雾的dsRNA,已将RNA生产成本降低到1美元/g。不久之后,Greenlight™系统将进一步把dsRNA合成成本降低到小于0.5美元/g(https://www.greenlightb iosciences.com/)。
最后,政府部门的投资在RNAi产品开发方面起着举足轻重的作用。绿色、高效、环保是未来杀菌剂的发展趋势。由于目前RNAi杀菌剂的大规模应用前景还不明朗,所以很难吸引到私营企业的投资。当前,大多数RNAi杀菌剂的项目都是由政府资金资助,由高校及研究所进行研究。不同收入国家政府部门在科学技术研发方面的投资存在差异。例如:中国、印度和巴西等政府大大提高了农业研究能力和农业产量,但撒哈拉以南的非洲政府对科研的投资总体上已停滞或呈下降趋势。由于RNA药物研究热度的提升,全球从2018年开始,与RNAi杀菌剂相关的基础研究大幅增加。
4 结论
RNAi是一项强有力的技术,不仅可以开发为新一代农药单独使用,还可以将RNAi药剂与化学农药结合使用,解决当前生产实际中的问题。尽管最近RNAi抗虫产品已经获得EPA的批准,但RNAi的大规模商品化仍面临一些困难。在真菌中,dsRNA的摄取、递送和RNAi的稳定性等RNAi相关机制仍未完全明确。开发RNAi生物杀菌剂作为一种有效且环境安全的植物病害防治方法是一个长期目标。在目前RNAi杀菌剂面临各种障碍和问题的情况下,我们认为,最有可能实现的是将RNAi杀菌剂与化学杀菌剂协同使用,可以获得最大效益。一方面可以减少化学农药的使用量,一方面可以治理化学农药抗药性问题。首先,因为RNAi杀菌剂机理与化学杀菌剂不同,所以可以对已产生化学杀菌剂抗药性的群体产生选择压,延缓抗药性群体的扩展;其次,协同使用可能存在增效作用,减少药量的同时可以提高RNAi和化学杀菌剂的防治效果;最后,由于RNAi杀菌剂一般是水溶性的,它可以减少化学农药中溶剂、添加剂和其他化学品的使用。总之,核酸农药是适应未来农业发展方向的极具潜力的新型植物保护产品,对我国的粮食安全具有重要的战略意义。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。