
含硫中心手性的亚砜衍生物广泛存在于药物分子、农药分子和生物活性分子之中。由于立体化学在生物分子识别和毒理中的重要性,硫立体中心的绝对构型对其生物特性至关重要。例如,在植物保护中,(R)-构型的氟砜草胺对抗性杂草表现出显著的除草活性,而其(S)-对映异构体的活性较低,对水稻植物表现出明显的毒性。此外,含硫立体中心的分子在不对称有机合成中可以作手性助剂、配体和催化剂。因此,在过去几十年中,含S-立体中心的化合物的制备引起了相当大的关注。目前,有关手性亚磺酸酯的构建报道很少,基本都基于肽或金鸡纳生物碱催化的亚磺酰氯与醇的动态动力学拆分(图1B-1),也有通过过渡金属催化对映选择性氧化和其他C-S键形成转化来制备高价值手性亚磺酰基功能分子。尽管如此,催化剂控制的S立体选择性合成仍然是一个相当大的挑战,特别是,关于使用小分子催化剂来控制具有高对映选择性的硫立体中心的构建研究非常有限。
池永贵教授团队致力于在有机合成和绿色医药农药研发生产领域开展原创性工作。近日,贵州大学伍星星/池永贵教授团队报道了一种有机催化策略,利用酸酐/酰氯原位活化亚磺酸盐形成混合酸酐,通过使用一个简单的天然金鸡钠生物碱奎宁作催化剂,高效地控制手性S-X(X = O, N)键构建,从而实现醇和胺的高度实用和对映选择性亚磺酰化反应,得到一系列具有优异光学纯度的手性亚砜衍生物(图1B-3)。值得注意的是,该方法首次通过催化剂控制实现了对氮亲核试剂高选择性的亚磺酰化反应。此外,该方法可方便地与各种天然产物和商业药物进行偶联反应,进而实现对重要生物功能分子的后期多样性修饰。
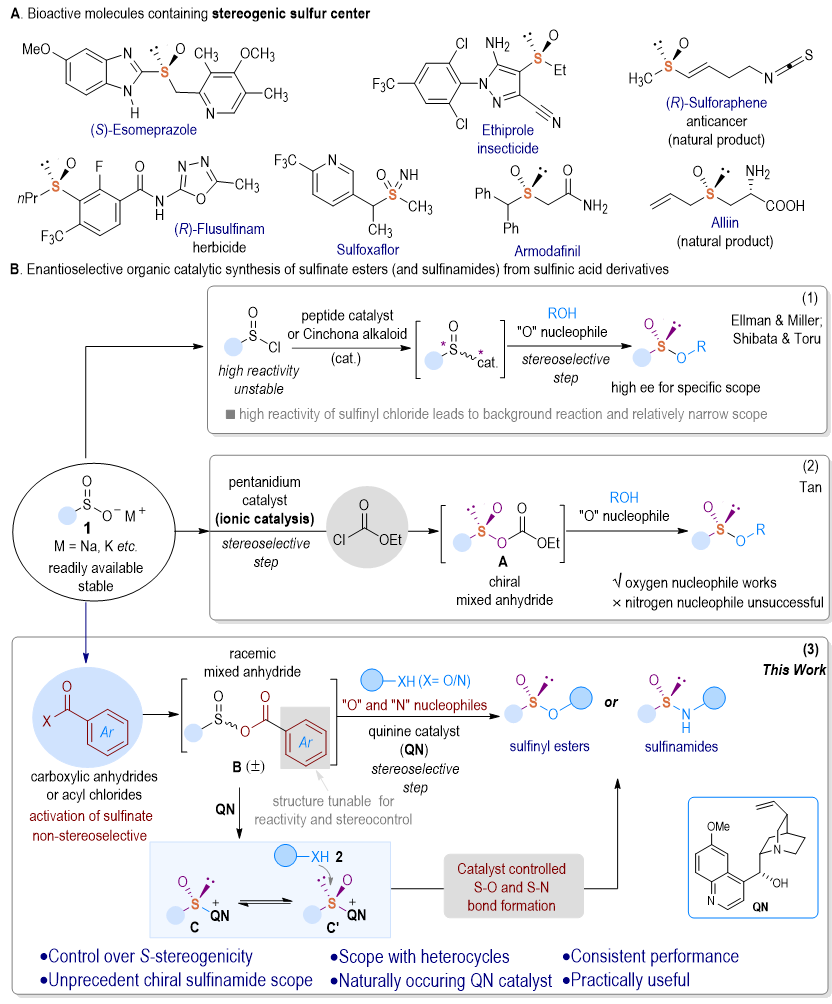
图1 硫手性构建催化合成策略
作者选择廉价易得的苯亚磺酸钠(1a)和正丁醇(2a)作为模板底物,开始了关于醇作亲核试剂的不对称缩合反应研究。首先使用酸酐3a原位活化亚磺酸盐,利用路易斯碱催化剂调控随后的S-O键形成过程中的立体选择性。为此,作者筛选一系列不同的手性有机催化剂,例如N-杂环卡宾(A-C)、异硫脲(D) 和金鸡钠生物碱(E)(图2,entry 1-5)。典型的路易斯碱A-D能催化得到亚磺酸酯,但无对应选择性(图2,entry 1-4)。天然存在且价格便宜的金鸡钠生物碱E在催化不对称缩合反应中表现出优越的性能,以60%的产率和良好的对映选择性(87︰13 er)得到产物4a(entry 5)。随后,作者测试了一系列以金鸡钠生物碱为基础的催化剂F-H,以及双官能团催化剂I-J(entry 6-10)。不幸的是,这些条件并未改善产物的选择性。随后使用金鸡钠生物碱E作为催化剂测试了酸酐3b和3c(entry 11-12),研究发现,具有邻二取代基团的酸酐3c可以合成高度立体选择性的产物4a(95︰5 er,entry 12)。作者进一步探索醇2b-d(entry 13-14)。虽然甲醇得到产物4b的对映选择性略有下降,但与乙醇反应可以得到相同的95︰5 er的产物4c(entry 13-14)。值得注意的是,使用异丙醇(2d) 可以84%的产率和优良的97︰3 er得到手性产物4d(entry 15)。此外,通过使用金鸡钠生物碱E的假对映异构体金鸡钠碱F,还可以轻松得到4d的另一个对映异构体(4︰96 er)。
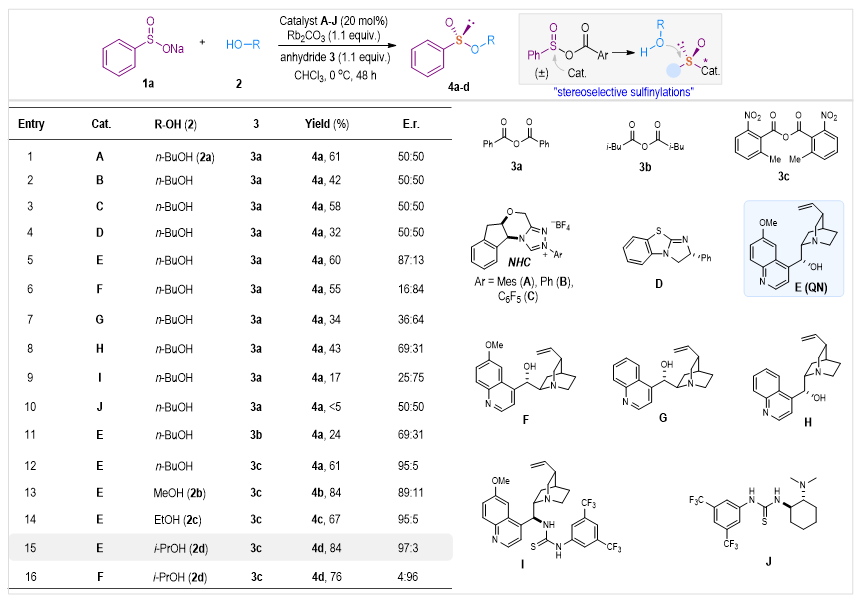
图2 硫手性构筑催化条件筛选
在确定了最佳反应条件后,作者研究了奎宁催化合成手性亚磺酸酯的底物普适性(图3)。首先探索了亚磺酸盐底物1上的取代基,苯基部分的对位、邻位或间位具有一组不同基团(CH3、Et、Ph、OCH3、卤素等)的芳香族亚磺酸钠1,以69%~88%的产率和95︰5至98︰2 er的优异对映选择性得到了相应的产物4e-4o。值得注意的是,在最佳条件下,该反应能够通过使用10 mol%的催化剂E进行克级规模反应,并以优异的对映选择性得到产物4e。具有强吸电子NO2的亚磺酸钠在催化条件下也能很好地进行,以51%的产率和92︰8 er立体选择性得到亚磺酰基产物4p。同时1-萘、2-萘亚磺酸盐也能顺利反应,得到相应的手性亚磺酸酯,此外,所开发的方法也适用于烷基亚硫酸盐底物,分别以99:1和91:9 er得到相应的产物4s和4t。作者还研究了杂芳基亚磺酸盐的适用范围,以中等产率和高对映选择性制备了具有各种取代的噻吩亚磺酸酯4u-4w。此外,以前报道中未实现的含氮杂环,如喹啉和吡啶亚磺酸盐,也可以得到所需的产物4x-4aa,这大大扩展了方法的范围和合成实用性。接下来,作者还探索了一系列醇,如t-BuOH (5a)、BnOH(5b)和4、6或7元环状醇(5c-5e)、笼状金刚烷醇(5f)以及光学纯的醇(5g-5h)反应,都能以优异的非对映选择性得到相应的手性亚磺酸酯。此外,天然醇,如(D)/(L)-薄荷醇(5i和epi-5i)、(-)-α-萜品醇(5j)以及雄酮(5k)和孕烯醇酮(5l),也能以中等的收率和优异的立体选择性获得相应的手性亚磺酸酯产物。
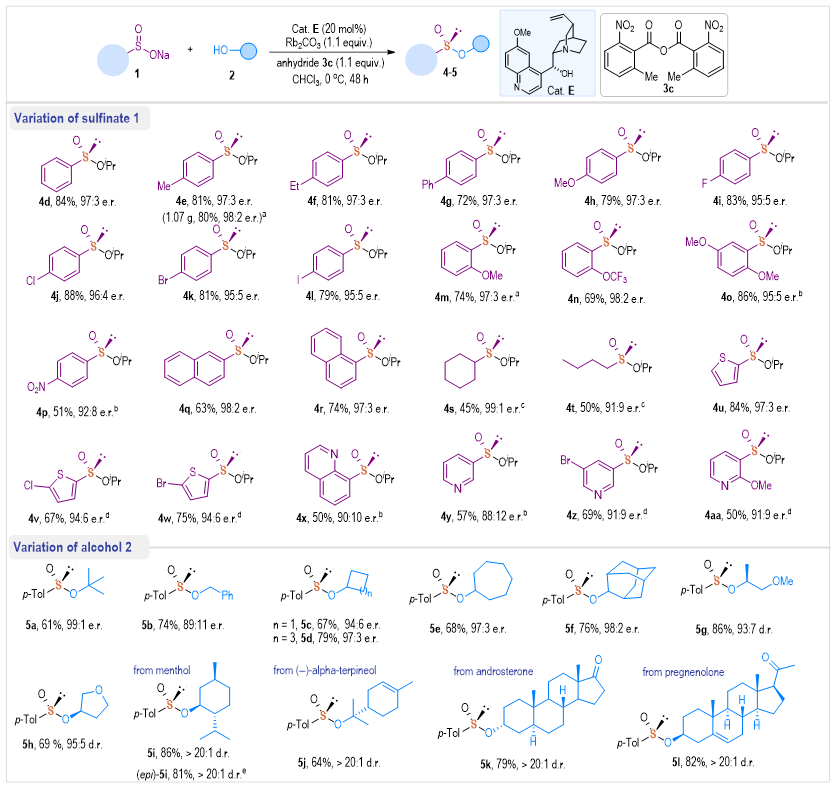
图3 手性亚磺酸酯不对称合成研究
在合成一系列的亚磺酸酯后,作者尝试了其它的亲核试剂(例如胺或者酚),比较遗憾的是只得到了胺或酚进攻酸酐3c的产物,接着作者经过分析和设想,可能是酸酐与亚磺酸盐形成混酐的速率比较慢,而胺或者酚的亲核性又比较强,通过对反应过程稍作修改,包括使用酰氯3d而不是酸酐3c来预活化亚磺酸盐,即能以良好的产率和优异的对映选择性成功制备各种亚磺酰胺。最初通过使用六甲基二硅氮烷 (HMDS)作为胺亲核试剂,在简单的后处理后进行温和的脱硅,可以容易地以71%的产率和98︰2 er获得N-未取代的亚磺酰胺8a。接着作者对底物的普适性做了考查,在亚磺酸盐1的芳基部分的对位、间位或邻位上的一组不同的取代基,包括烷基、Ph、OMe、卤素和NO2等,都是兼容的,可以以48%~80%的产率和优异的对映选择性制备手性各种芳基亚磺酰胺8c-8m。同时,具有脂族部分的亚硫酸盐(8n-8p)也能以中等的收率和优异的立体选择性获得相应的手性亚磺酰胺。随后,作者还探索了芳基胺的对映选择性亚磺酰基化反应,发现催化条件对各种取代基(如烷基、卤素、CF3等)和N-芳基上的取代模式显示出非常广泛的范围,从而制备了一系列的N-芳基亚磺酰胺8q-9e,产率为68%~92%,并且具有优异的光学纯度(er高达99︰1)。此外,所开发的策略还可以在其他胺亲核试剂上实现对映选择性亚磺酰基化,包括伯或仲烷基胺(9f-9j)、无氮亚胺(9k),从而以高产率高效制备高度对映富集的亚磺酰胺9f-9k。

图4 手性亚磺酰胺不对称合成研究
利用该方法所制备的手性硫产物为进一步转化提供了多种方法。例如,最初使用各种格氏试剂对亚磺酰基酯(R)-4e进行亲核取代,以高产率和优异的对映选择性得到手性亚砜(S)-10-12(图5-A)。此外,在添加乙烯基格氏试剂作为亲核试剂时,可以顺利地合成不饱和亚砜(S)-13。另外,通过添加相应的亲核试剂可快速制备在不对称催化中有应用潜力的双齿配体,如吡啶亚砜(S)-14和膦官能化亚砜(R)-15。另一方面,亚磺酰胺是多种立体选择性合成的特殊手性前体,在碱性条件下,直接获得烷基化亚磺酰胺(S)-16(图5B);通过PhI=O氧化,(S)-9g很容易转化为亚磺酰亚胺酯(R)-17,该结构可作为一种极有潜力的药物骨架;制备的高光学纯亚磺酰胺类化合物可作为手性助剂用于立体选择性合成,例如,以91%的收率制备了手性氮丙啶18;此外,作者还探索了几种含有苯胺骨架的药物分子,如苯佐卡因、普鲁卡因和丁卡因利用该催化方法可进行前药分子修饰,得到它们相应的药物分子(S)-19-21(图5C)。
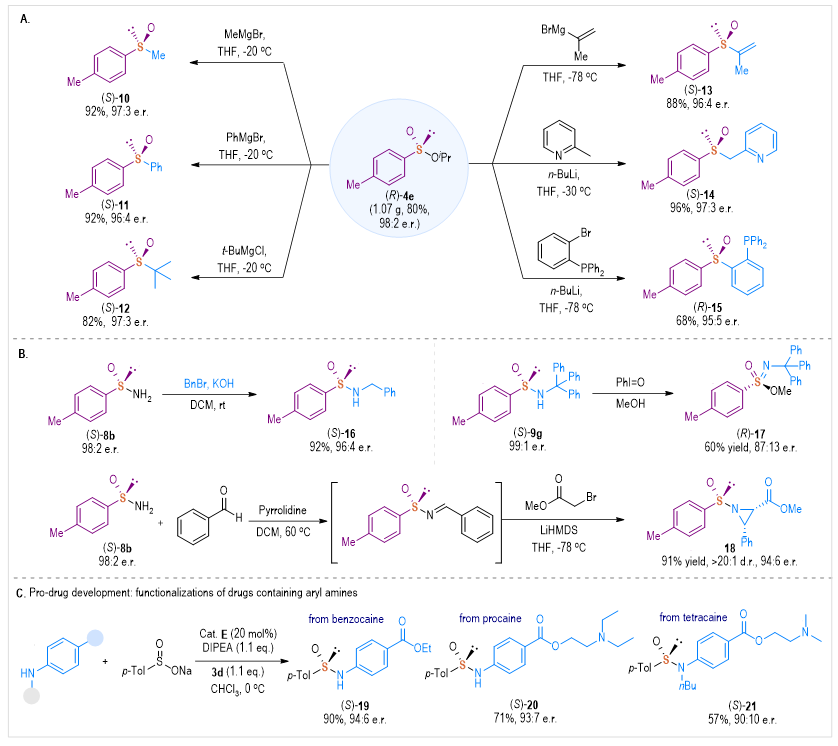
图5 产物多样性衍生
总 结
贵州大学伍星星/池永贵团队成功开发了一种金鸡钠碱催化高效构筑手性亚砜衍生物的方法。在奎宁催化混合酸酐的条件下,以高产率和优异的立体选择性获得了一系列的硫手性化合物,同时解决了以胺做亲核试剂所面临的化学选择性和对映选择性的长期挑战。此外,该方法还可以与各种天然产物和商业药物进行偶联反应,进而实现对重要生物分子的前药多样性修饰。此工作部分结果近期发表于Chem上。贵州大学绿色农药全国重点实验室、绿色农药与农业生物工程教育部重点实验室二年级博士生廖明洪为论文第一作者。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。