
欧盟农药管理文件没有对微生物农药定义,但微生物(micro-organism)却被经常使用,植物保护产品活性物质也包括了微生物和病毒。
1 欧盟微生物农药登记管理法规和登记资料要求
执行Regulation(EC)No 1107/2009前,欧盟农药管理依据理事会指令Council Directive 91/414/EEC,其附录Ⅱ为农药活性成分登记资料要求,包括化学农药(常规农药)有效成分(Part A)和微生物农药活性成分(Part B)2个部分;附录Ⅲ为制剂登记资料要求,包括化学农药制剂(Part A)和微生物农药制剂(Part B)2个部分。Regulation(EC)No 1107/2009的附录不再包括资料要求,活性成分和制剂的登记资料要求分别通过Commission Regulation(EU)No 283/2013和Commission Regulation(EU)No 284/2013予以规定,都包含化学农药和微生物农药2个部分。
Regulation(EC)No 1107/2009登记资料要求脱胎于化学农药登记资料要求,不能很好地适用于微生物农药评审要求。风险评价的终点没有清楚的定义,可能产生不同的解释,甚至要求更多资料。登记评审不透明、费用高、登记时间也远长于美国(表1)。
表1 欧盟新旧法规评审/登记程序及其所需时间
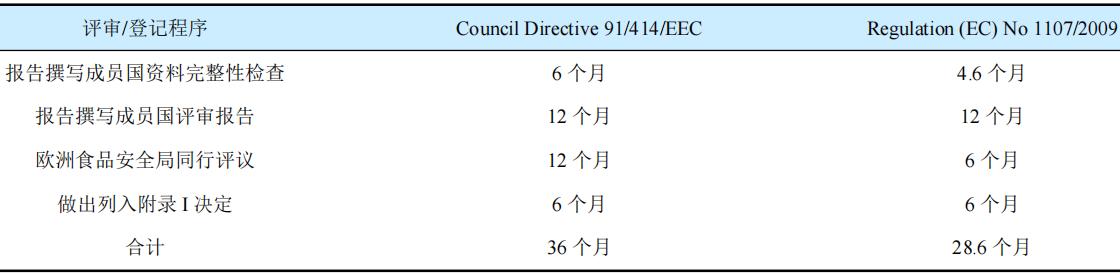
新的数据要求于2013年发布,低风险标准也于2017年发布,为什么现在还会有这些问题呢?2019年德国SCC科学咨询公司(SCC GmbH-Scientific Consulting Company)Lars Huber博士指出,以微生物为例,2013年法规Regulation(EC)No 283/2013和Regulation(EC)No 284/2013新发布的一般数据要求,仍有沿用2011年(Council Directive 91/414/EEC有效期至2011年)的数据要求,而沿用的这些数据要求是针对化学活性物质。例如,管理术语“代谢物”“相关代谢物”或“次级代谢物”均适用于化学制品,而与微生物的生物学特性毫无关联。
2 微生物农药登记管理法规修订
欧盟修订了微生物农药管理法规和登记要求,并于2022年2月8日,欧盟成员国批准了4项实施法规(Implementing Regulations)。实施法规修订主要针对微生物农药的登记管理,通过修订委员会法规Commission Regulation(EU)No 283/2013和Commission Regulation(EU)No 284/2013,改进微生物农药登记资料要求(Part B)。
4项实施法规分别是:① 修订Regulation(EU)No 283/2013:修订关于微生物有效成分的审批标准。② 修订Regulation(EU)No 284/2013:修订关于含有微生物的原药审批的资料要求。③ 修订Regulation(EU)No 546/2011:评价和授权含微生物生物制剂产品的资料要求。④ 修订Annex Ⅱ to Regulation(EC)No 1107/2009:含有微生物的植物保护产品评估和授权的具体统一原则。
新法规基于每种微生物的生物学和生态学特征,并结合了最新的科学知识。新法规有利于促进微生物作为植物保护产品中的活性物质的审批以及含有这些活性物质的制剂产品的登记。新法规对微生物的管理要求“因地制宜”、更加灵活,新的登记要求需要的动物实验更少,有望给欧盟作物保护和农业生产带来诸多好处。以最新科学为依据的新法规使欧盟成为微生物农药全球最先进的管理机构之一。
从农场到餐桌战略和绿色协议旨在减少对化学农药产品的依赖和使用。欧盟拟修订和实施新的微生物农药登记要求可以促进微生物农药的使用,新的登记数据要求有利于含有微生物的植物保护产品更快地进入欧盟市场。新法规与欧洲绿色协议(European Green Deal)完全配合,有利于实现从农场到餐桌战略(Farm to Fork Strategy)。
微生物的生物特性在风险评估中起核心作用,新的实施行动所需的许多数据都以特定微生物的生物学和生态学为条件。任何情况下,一种微生物只有被证明不会引起人类或动物疾病情况下才能获准使用。
自然产生且大多无害的微生物在生态系统中具有重要的作用,例如,通过分解土壤中的有机物使其为其他生物所用,或通过向土壤中添加大气氮(固氮)使其为植物所用。
微生物的使用几乎和人类存在的时间一样长,比如面包、奶酪、啤酒和葡萄酒的制造重都有微生物的作用,“百姓日用而不知”。在现代,它们的用途被扩大了,如作为食品/饲料添加剂中益生菌的基本成分,或用于生产药用活性物质等。
与植物保护产品使用的所有其他活性物质一样,微生物只有符合监管法规制定的审批准则,才可获准使用。
成员国、欧洲食品安全局(EFSA)和欧盟委员会在每一种活性物质进入市场并用于植物保护产品之前,都要对其对人类和环境的安全性进行评估。然后再由成员国授权每种含有获批准活性物质的植物保护产品用于预期用途。目前,经过科学风险评估证实在植物保护产品中使用的安全性之后,欧盟已经批准了70多种微生物活性物质作为植物保护产品的有效成分。
含有微生物的生物农药产品,如果在最佳条件下正确使用,可能与化学农药一样有效。在条件不是最优的地方,它们可能不如化学农药有效,因为作为生物,它们需要“最优使用条件”才能成功控制有害生物。
这些生物制品在有机农业中发挥着关键作用,农民可以使用微生物作为生物控制剂。新法规将加强微生物植物保护产品的市场准入,为欧盟有机种植者提供新的可持续替代品来控制植物有害生物。欧盟有机农业将受益于微生物植物保护产品的引进。2019年,欧盟有近33万有机农民,在某些成员国的农业面积中占比高达20%。此外,“从农场到餐桌战略”的目标之一是增加欧盟有机农业的总耕地面积,到2030年欧盟至少有25%的农业用地是有机农业。
微生物在有害生物综合治理中也发挥着重要作用:在使用化学植物保护产品之前,农民必须优先考虑预防措施、监测和使用生物农药(包括以微生物为基础的产品)。有害生物综合治理的目的还在于将农药的使用和其他形式的干预措施控制在经济和生态合理的水平,同时还可以采用其他措施,如轮作、选择适当的品种和栽培技术。
3 修订前后的微生物活性物质评审和制剂登记要求对比
修订前后的微生物农药活性物质审批要求和制剂登记要求对比分别列于表2和表3中。
表2 微生物活性物质审批资料要求修订前后的比较


表3 欧盟微生物制剂产品登记资料要求修订前后的对比


需要说明的是,如果有效成分是化学物质(包括化学信息素、生物材料提取物),或由微生物产生的代谢产物,即从微生物中纯化得到的代谢产物,或不是从不再能够复制或转移遗传物质的微生物提纯的代谢物,那么需要根据化学农药有效成分登记要求提供相应的登记资料。
在申请微生物活性物质的审批时,申请人必须提交一个代表性制剂产品的数据,因此在欧盟层面的活性物质评估是决定相关制剂能否进入市场的关键。活性物质通过评审后,相关制剂的评审则可参考活性物质评审信息和评审结果。
证据权重法的含义:当某项从每个毒理数据源得到的数据被认为不足以支持某个观点时,则从若干个独立的数据源得到的综合证据可能具有足够的权重,将对该物质有某项特殊的危害特性做出假设或结论。如就健康危害评估而言,可通过整合化合物构效关系、毒理学、流行病学和医学等相关数据和信息,来确定用于制定安全限值的敏感效应终点。
3.1 修订后的微生物活性物质审批要求、制剂登记授权与化学活性物质及制剂登记授权的不同之处
3.1.1 微生物活性物质和制剂资料要求的历史回顾
Council Directive 91/414/EEC的附录Ⅱ中分别规定了化学农药和微生物(包括病毒)农药有效成分的审批资料要求。而在附录Ⅲ中分别规定了化学农药和微生物(包括病毒)农药制剂的登记要求。但是这些资料要求的设定与化学农药的基本一样。
在Regulation(EC)No 1107/2009之后,发布了Commission regulation(EU)No 283/2013和Commission regulation(EU)No 284/2013,分别制定了化学农药和微生物农药活性物质审批以及化学农药和微生物农药制剂的登记资料要求。欧盟在评价几个新的由微生物活性物质组成的产品期间积累一些经验,认为可以引入更精确的微生物数据要求,特别是职业健康、消费者接触和环境风险等方面可以进行重大改变,于是欧洲委员会在2001年又颁布了委员会指令Commission Directive 2001/36/EC,修订了Council Directive 91/414/EEC附录Ⅱ和附录Ⅲ对微生物活性物质审批和制剂登记的资料要求。委员会认为,应该将微生物农药的登记要求与化学农药区分开来,如关于环境中的归宿和行为以及残留的要求是适用于化学品的,而其他的如关于传染性的,则是专门针对微生物的。
3.1.2 修订后的微生物活性物质审批要求的变化
修订的目的是进一步将微生物活性物质审批要求与化学活性物质进行区别。与修订之前相比,修订后主要在如下几个方面体现出与化学活性物质审批的不同(表2)。
(1)关于微生物的鉴定
“应使用最好的可用技术在菌株水平上鉴别和描述微生物”。这一点在Council Directive 91/414附录ⅡB中已经有相同的措辞。还强调在进行微生物鉴定时不需要全基因组序列(WGS)数据。
实施Regulation(EC)No 1107/2009之后,重新制定了微生物活性物质审批资料要求法规Commission Regulation(EU)No 283/2013和制剂登记授权的资料要求法规Commission Regulation(EU)No 284/2013。由于微生物的作用方式往往基于微生物产生的代谢产物(化学物质),因此对于微生物产品中的代谢物的资料要求,按化学农药对待还是按微生物对待,在Commission Regulation(EU)No 283/2013和Commission Regulation(EU)No 284/2013中仍存在不确定性。
修订后的法规Draft Commission Regulation(EU)No 283/2013和Draft Commission Regulation(EU)No 284/2013试图澄清这种情况。如果产品是从微生物中纯化的代谢产物或含有代谢产物的产品中微生物已经死亡(不再能够复制或转移遗传物质),此时Part A(化学活性物质)是适用的。对单一或确定的微生物组合,或者声称只有在活的微生物存在时才有助于植物保护产品发挥作用的代谢产物,Part B(微生物)适用。
(2)微生物防治剂试验样品
该修正案引入了术语“生产的微生物病虫害控制剂的原样(microbial pest control agent as manufactured,MPCAAM)”,因为需要使用生产的MPCAAM样品进行某些测试,而不是使用纯化后生产的活性物质或MPCAAM的其他成分。
(3)使用WGS鉴定所关注的代谢物
必须通过各种方法,如根据科学文献,来确定所关切的代谢产物。根据全基因组序列数据分析,确定编码代谢产物的基因的缺失被认为是证明该代谢产物不存在危害的重要手段。
如果代谢产物对微生物产品的作用方式有贡献,或者预计会有显著的残留物,那么需要提交代谢物的数据。
(4)获得性和内在抗菌素耐药性(AMR)及植物保护微生物的AMR评价
Part B还定义了获得性和内在抗菌素耐药性。如果某个抗菌素耐药性基因:① 位于染色体上;② 缺乏可移动的遗传元素;③ 由同一物种的大多数野生型菌株共有,则该基因被认为是固有的。而获得性抗菌素耐药性意味着:① 非内在的和获得性的新抗性;② 使微生物能够在抗菌剂的存在下生存或繁殖;③ 浓度高于抑制同一物种野生型菌株的浓度。
如果认为细菌菌株不具有任何已知的、功能性的和可转移的对相关抗菌药物耐药的基因编码,则可以批准其为活性物质。此外,如果其对至少2类抗菌药物的易感性已被证明,则活性微生物物质可以被认为是低风险的活性物质。低风险物质的批准期限为15年,长于正常的10年。
此外,在数据要求方面,修订后采用证据权重法,综合利用已有信息,尽可能减少毒性试验研究的需要。
继Regulation(EC)No 1107/2009实施以后,所有获得欧盟批准的农药活性物质都要被列入Commission Implementing Regulation(EU)No 540/2011的附录中(Part A~E)。其中Part A是始于2011年的最初批准的活性物质;Part B是更新和新批准的活性物质;Part C是批准的基础物质;Part D是批准的低风险活性物质;Part E则是替代候选物质。该法规中的附录随活性物质审批的进行不断更新其附录。
目前为止,根据欧盟农药活性物质数据库查询得知,共有73个微生物活性物质获得了欧盟的批准。根据前述已批准的低风险物质名单,23个微生物活性成分被列为低风险物质,其余51个微生物活性成分属于普通活性成分。
3.2 修订后的微生物制剂登记授权要求的变化
微生物制剂的登记授权应基于微生物活性物质的评审结果。原则上,通过活性物质评审的微生物使用到制剂中,只要添加剂如助剂、增效剂和安全剂等是经过安全评价的物质则可以减免很多制剂的资料要求,尤其是对人的健康影响、环境归宿和行为、生态毒性等。
从表3的分析可见,修订后的主要变化体现在下面几个方面:
(1)修订后,引进了证据权重法,试图更充分地利用现有信息,以便尽最大程度地减少对试验研究的要求。
(2)对某些项目的要求有更为充分的说明,试图让申请人更容易理解和掌握相关的数据要求。但是也同时降低了可操作性。
4 微生物农药制剂统一评价原则的修订
继Council Directive 91/414/EEC实施之后,又制定了Council Directive 94/43/EC,建立了Council Directive 91/414/EEC的附录Ⅵ,即农药登记的统一评价原则。这个统一评审原则文件主要适合于化学农药。
为了适合微生物农药登记评审的特殊要求,2005年欧盟委员会又为成员国制定了微生物农药制剂的统一评价原则,即Council Directive 2005/25/EC。
新的法规Regulation(EC)No 1107/2009出台之后,又重新制定了化学农药和微生物农药制剂的统一评价原则[CommissionRegulation(EU)No 546/2011]。
2022年8月,欧盟委员会对Commission Regulation(EU)No 546/2011作进一步修订。
Commission Regulation(EU)No 546/2011(2011年6月10日实施)规定了植物保护产品的评估和批准的统一原则。该法规附件之Part A和Part B分别适用于含有化学物质和微生物的植物保护产品,是现有的评估植物保护产品是否可能对人类健康、动物健康产生有害影响的统一原则,或在获得批准后对环境产生不可接受的影响的统一原则。
“从农场到餐桌战略”是欧盟委员会建立的公平、健康和环境友好型食品体系战略,旨在减少对化学植物保护产品的依赖和使用,包括促进微生物等生物活性物质的投放市场。为了实现这些,必须考虑到已经发生重大变化的最新科学和技术知识,就含有微生物的植物保护产品制定统一的评审原则。
因为微生物是有生命的有机体,所以需要一种特定的方法来与化学物质比较,以便也考虑到关于微生物生物学的科学现状,因为它们是有生命的有机体。这些科学知识包括关于微生物关键特性的信息,例如它们的致病性和传染性、可能产生的相关代谢物以及将抗菌素耐药性基因转移到其他具有致病性并发生在欧洲环境中的微生物的能力,这可能影响人用和兽用抗菌素的有效性。因此,需要进一步规范数据要求,以落实关于抗菌素耐药性可转移性的最新科学和技术知识,并确保对活性物质是否可能对人类或动物健康产生有害影响进行评估,如法规Regulation(EC)No 1107/2009第4条所规定的对人类和动物健康影响的审批标准所示。
现有的关于含有微生物的植物保护产品的科学知识使人们可以采用更好和更具体的方法来评估这些产品,评估方法是根据各自物种的作用方式和生态特征,并在可能的情况下据各自的微生物株系进行。由于可以更有针对性地进行风险评估,所以在评估含有微生物的植物保护产品所带来的风险时,应该考虑到这些科学知识。
因此,为了更好地反映最新的科学发展和微生物的特性,同时保持对人类和动物健康以及环境的高度保护,有必要相应地调整现有的统一评审原则。
5 关于微生物农药测试方法
关于微生物农药的测试,目前没有全球统一的方法。OECD在这方面一直试图开发出一套供OECD成员国使用的方法,但目前还未成熟。而美国EPA早在1996年就发布了一套专供微生物农药的测试方法,即所谓的885系列方法。FAO/WHO在其微生物农药登记要求指导文件中,也推荐使用美国EPA和OECD的相关方法。欧盟一直采用美国的885系列方法。
5.1 OECD微生物测试方法开发进展
2019年,OECD举办了第九届微生物农药工作组关于微生物测试方法的研讨会。此次研讨会对用于人类健康和环境风险评估的不同测试方法以及在实施和解释过程中出现的挑战和问题。整个研讨会的目的是为了提出改进微生物检测方法的建议。
管理当局和利益相关者确实认识到现有测试方法对微生物测试的价值,但是,同时他们承认现有方法存在一些固有局限性,但是目前已经获得的经验和当前的科学进步可以解决这些测试方法的局限性。鉴于可靠地评估微生物农药安全性的测试方法具有十分重要的意义,因此管理部门和利益相关者应该共同努力改进这些方法。
OECD举办的第九届微生物农药工作组关于微生物测试方法的研讨会是为了介绍和讨论现有微生物测试方法的适用性,说明生物农药登记申请者和管理者面临的障碍和问题,并启动程序,提出改进微生物检测方法的建议。
此次会议主要总结了:① 来自利益相关者的经验和观点,包括OECD关于数据要求和测试准则调查的背景和反馈;微生物,及对人类毒理学的挑战;欧盟的经验:测试方法和微生物的评价;微生物农药生态风险评估;水生和陆生:微生物和非生物的试验方法;传粉昆虫和微生物测试方法;微生物的长期水蚤毒性研究(OECD TG 211)的经验和对研究设计的修改建议;如何开发和将OECD化学品测试指南用于微生物。② 来自政府的经验和观点,包括澳大利亚、日本、美国、加拿大对微生物测试方法的经验。
研讨会期间的一个普遍看法是,大多数OECD成员国对微生物生物农药登记的数据要求大多与化学农药相同。为此,为了提供某些数据,还是使用化学农药评估方法对微生物农药进行测试。在某些情况下,使用由美国EPA开发的支持微生物防治剂的登记的单独的测试指南(885系列)。但是,有人指出,其中一些微生物的检测方法:① 存在一定的技术局限性;② 获得的结果不容易解释;③ 被认为已经落后于目前的科学发展。
人们也承认在过去的20年中,在使用某些化学农药测试指南并将之用于微生物测试,或开发新的替代方法更好地满足它们的需求等方面,积累了丰富的经验。
还强调指出,应对现有测试方法在处理微生物农药登记要求的数据方面的价值进行审查。有人建议工作应该首先重点改进现有的测试方法,然后逐步地使用科学论证对微生物农药登记要求的数据进行修改。
与会者提出了若干建议,为改善微生物农药的测试铺平了道路:① 审查所有的测试方法,并在使用时识别它们在检测微生物方面的局限性;② 准备一份界定范围的文件,为全面覆盖各类微生物测试,找出现有方法的局限性和可能的解决方案,以完善微生物检测方法;然后,顾及到活性生物的生物学特性,考虑改编和改进现有的测试方法或开发新的替代方法;国际植物传粉者关系委员会(ICPPR)微生物研究小组正在进行的工作将被考虑;③ 为免除对某些数据的要求,可以准备具有科学论据的文件以满足数据要求(如对蚯蚓和弹尾/弹尾测试的要求)。
2020年,OECD召开第十届微生物农药工作组关于生物信息学和微生物农药管理研讨会。本届会议主要探讨生物信息学在微生物管理中的应用。下列结论和建议作为会议的结果进行了讨论:
(1)人们认为在国际间协调微生物农药登记所需要的基因组数据类型和数据评估方式是很重要的。
(2)微生物农药行业应该学习其他领域正在发生的事情,例如向食品和饲料添加剂行业学习。
(3)由于管理当局内部的专业知识分析对现有数据的能力可能有限,因此可能需要针对新方法进行培训。
(4)在这个阶段,还没有设想使用基因组测序,生物信息学工具和数据库将导致新的数据需求。WGS可以用于处理微生物登记的某些数据要求,特别是在微生物鉴定、表征和抗菌物质耐药性基因确定方面。但是,应进一步考虑是否有可能使用WGS作为标准数据需求。
(5)应更多地利用生物信息学技术进行全面风险评估。
(6)关于如何利用生物信息学促进微生物农药的登记,应确定一些可能的研究案例。
可见,此次研讨会是前瞻性的,对于生物信息学未来在新颖农药登记中的应用前景目前仍保持谨慎态度。
5.2 美国EPA开发的微生物测试方法
美国于1996年最早开发了专用于微生物农药的各种测试方法指导,最终目的依据美国农药法规FIFRA,为支持微生物农药登记而开发的,满足对微生物防治剂的组成、环境影响和人类健康影响进行测试的要求。
这些方法被称为885系列方法,覆盖微生物农药评价的各个方面。
6 欧盟、美国和FAO/WHO微生物农药登记要求特点比较
以下是笔者根据微生物农药登记资料的特点,从几个特殊方面的资料要求对欧盟、美国和FAO/WHO的登记要求做了简单的对比。
(1)批次分析:欧盟要求至少5批次预案要分析。美国要求多批次分析,但是没注明几个批次。FAO/WHO也要求3~5批次的原药和制剂样品分析(适用于批次生产情况)。
(2)次生代谢产物:美国没有提到微生物次生代谢产物,死的和活体微生物农药一样管制。欧盟对次生代谢产物尤其关注。FAO/WHO也在登记要求中始终关注相关次生代谢产物(毒素)。FAO/WHO给出相关次生化合物(代谢物)的定义:与人类或动物健康和/或环境有毒理学关系的任何次生化合物(代谢物),一些毒素可以被认为是相关的次生化合物(代谢物)。
(3)对抗菌素的耐药性:欧盟特别关注微生物的抗菌素耐药基因(antimicrobial resistance genes),美国没有提及。FAO/WHO也要求提供微生物对人或兽医用抗生素/抗菌剂的耐药性/敏感性数据。
(4)美国和FAO/WHO均按照使用模式有区别地要求登记资料。欧盟没有强调这一点。除了公共卫生用微生物农药以外,美国对其他微生物农药不要求提供药效资料(美国对其他农药也如此)。而欧盟和FAO/WHO要求较为详细的药效资料。
(5)美国和FAO/WHO对残留和环境归宿等资料多为视情况而要求,以尽可能减免要求为宗旨。只要求某些关键的生态毒性资料,如对鸟、蜜蜂、非靶标昆虫和某些水生生物的毒性数据。欧盟要求的信息和研究数据相对更多。
(6)污染微生物:欧盟要求相关污染微生物鉴定、含量和分析方法等,美国登记要求没有要求相关资料,FAO/WHO也要求污染微生物的相关资料。OECD出台有污染微生物限量规定。
(7)活性物质(原药)等同性认定:欧盟登记资料要求没有专门提及微生物活性物质的等同性认定。但是OECD出台有等同性认定指导。美国没有提到等同性认定。
(8)修订后的欧盟微生物资料要求引进“证据权重法”,以便尽可能地利用现有资料,减少对不必要的试验研究的要求。
(9)美国和FAO/WHO对登记资料的要求都有非常明确的说明,非常有利于主管部门和申请人理解掌握。相比之下,欧盟的说明则非常复杂,不确定性很大,不利于申请人理解和掌握,也极易增加评审结果的不确定性。
目前,全球不同地区/国家对生物农药的管理规定和登记要求差别很大。美国是全球生物农药登记要求最为灵活的,因此获得登记投放市场的品种和数量均居前列。欧盟过去要求相对苛刻,因此登记进程缓慢。
有些产品如植物农药和微生物代谢产物农药,由于对其“有效成分”的认定存在一定的困难,经常延缓登记进程,甚至导致登记失败。研究发现,植物农药和微生物代谢产物农药往往难以认定某单一组分是所谓的“有效成分”,而是多个组分协同作用才产生可以接受的应用效果。但是,管理者经常要求登记申请者提供活性组分的一系列资料,这显然是难以做到的,所需要的成本也是中小型企业难以负担的。
因此,综合考虑这类产品的安全性和在历史上长期安全使用等因素给予产品登记授权,加快此类生物农药投放市场是一个更为切实可行的思路。像对待化学合成农药一样对待生物农药的“有效成分”并提出类似要求则是不适当的。
美国在这方面相对灵活。甚至有些微生物杀虫剂的标签上把发酵产物整体计入有效物质含量。如MBI公司的微生物杀虫剂Grandevo®标签显示发酵物含量为30%(作为有效物质),已在美国、新西兰和智利获得登记。该产品是一种基于微生物的杀虫剂,其中包含数种活性化合物,可以驱避、阻止害虫取食,减少繁殖并诱杀吮吸和咀嚼式害虫,如苍蝇和螨虫种群。
苏云金杆菌杀虫剂在北美市场上销售的Dipel®DF标签含量为54%,是以发酵产物计量的。MBI公司的微生物农药产品Majesten®的活性成分是失活的伯克霍尔德氏菌属的A396菌株(Burkholderia spp. strain A396)的死细胞以及发酵液,杀线虫的活性物质来自于发酵过程中产生的代谢物。而且研究发现,该产品中含有多种次生代谢产物,它们的活性谱也不尽相同。这样的产品能在美国获得快速登记,而在欧盟是不可想象的。
7 小结
为了实现欧洲绿色协议和从农场到餐桌战略,欧盟于2022年修订了微生物农药监管和登记要求及登记评审原则等,以促进对环境和生态及人类更为友好的微生物农药的上市。从修订后的登记要求可见,虽然修订的初衷是加速微生物农药的上市,但在某些登记要求(如对次生代谢产物的资料要求以及对抗生素耐药性的信息)上则更为严谨。为了减轻资料要求负担,新修订后的资料要求引进了“证据权重法”以减少对某些试验研究的需要。虽然这次修订比以往有一定的进步,但是仍然有很多需要改进的地方,诸多方面的登记要求仍然受化学农药登记要求的限制。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。