
原标题:生物高纯精草:高光学纯L-草铵膦生物制造的创新与发展
草铵膦(英文名glufosinate或phosphinothricin;简称PPT)是一种氨基酸类除草剂,其历史可以追溯到1972年德国科学家从链霉菌发酵液中分离得到了一种具有除草活性的三肽化合物——双丙氨膦。他们对其结构鉴定,发现该三肽是由两分子L-丙氨酸以及一种当时还未知的氨基酸构成。而后,赫斯特公司采用化学法合成了这种未知氨基酸,并命名为草铵膦;同时,发现这种天然氨基酸具有非常好的除草活性。其原理是草铵膦在分子结构上与谷氨酸非常相似,故草铵膦与谷氨酰胺合成酶的活性位点可发生可逆结合,抑制了谷氨酰胺合成途径,导致植物体内氮代谢紊乱造成铵过量积累、叶绿体解体,从而使光合作用受抑制,最终导致植物死亡。
近年来,随着耐草铵膦转基因作物新品种的开发与推广,加上草甘膦抗性杂草的增加及百草枯的禁用(百草枯对人体毒性极大,且无特效解毒药)。草铵膦作为一种广谱、高效的非选择性除草剂获得了巨大的发展空间,2022年其市场规模超10亿美元,已成为全球第二大除草剂、用量最大的手性除草剂。随着新生代转基因的渗透、百草枯的禁用替代和复配制剂的增加,草铵膦需求量不断增加,其制造技术也不断发展,下面就D,L-草铵膦的主流生产工艺进行总结与分析。
1 D,L-草铵膦的主流生产工艺
D,L-草铵膦生产工艺壁垒较高,目前全球主要有3条草铵膦产业化生产路线:即热裂解-ACA工艺(简称“气相合成”)、铝法-Strecker工艺(简称“铝法合成”)、格氏-Strecker工艺(简称“格氏合成”)。但普遍面临反应条件要求高、工艺复杂、过程控制难度大、成本较高等问题,目前国内仅少数公司能实现规模化稳定生产。3种工艺方法在合成方法原理上有其相似之处,但在原材料成本、过程损耗、环保友好性和收率等方面区别较大。
1.1 热裂解-ACA工艺
热裂解-ACA工艺,主要分为3个步骤:① 在高温下以甲烷和三氯化磷为原料热裂解制备甲基二氯化膦(MDP),再与正丁醇制备甲基亚膦酸单正丁酯(MPE);② 丙烯醛在低温下一步制得丙烯醛氰醇乙酸酯(ACA),该步收率可达96%;③ MPE和ACA在过氧特戊酸叔丁酯(BPP)引发下进行Michael加成反应制备(3-乙酰氧-3-氰丙基)-甲基膦酸正丁酯,最后通过胺化水解得到D,L-草铵膦铵盐。该工艺总收率较高,经济环保(图1A)。
国内外许多研究团队都对该路线进行了深入研究,浙江工业大学是国内较早开展MDP化学合成研究的科研院校,采用氯甲烷为甲基供体合成MDP,转化率达81.3%。产业化方面,热裂解-ACA工艺由德国公司率先研发成功并实现了连续化生产,具有自动化程度高,反应过程中无溶剂、无气味,几乎无渣排放,胺化和水解后的水相都可以蒸发回收、套用等优点。整个工艺中最关键的核心技术和难点是中间体MDP的制备,这也是合成含磷农药的重要中间体。以气相连续法合成MDP技术壁垒最高,虽然该工艺已过了专利保护期,但因工艺标准要求极高(需要在600℃以上高温下气化裂解来制备MDP、高温反应时会产生固体沉积物吸附在反应器壁上等),国内仅极少数企业能够运用该工艺进行D,L-草铵膦的量产。
1.2 格氏-Strecker工艺
格氏-Strecker工艺相较热裂解-ACA工艺省去了热裂解步骤,工艺简单、成本较低,是我国企业普遍采用的工艺之一。该工艺通过格氏法合成关键中间体亚磷酸二乙酯:具体是利用乙烯利的前体亚磷酸三(2-氯乙基)酯,与三氯化磷酯交换,制得二(2-氯乙氧基)亚磷酰氯,再与甲基溴化镁格氏反应得到甲基亚膦酸二乙酯。而后,丙烯醛与乙醇生成的缩醛与甲基亚膦酸二乙酯发生Michael加成反应,酸化后得到3-乙氧基甲基膦酰基丙醛,加入氰化钠、氯化铵和氨水发生Strecker反应得到氨基腈,最后水解、胺化和纯化得到草铵膦铵盐,该工艺所得草铵膦的纯度可达95%,总收率在30%左右(图1B)。尽管该工艺路径较为简单,易于实现工业化生产,然而同时也存在安全隐患大(用到氰化钠等剧毒物质)、分离纯化难度大(导致废水量大)、收率不高(总收率低)等问题。
1.3 铝法-Strecker工艺
铝法-Strecker工艺是国内企业在格氏-Strecker工艺基础上开发的生产工艺。与格氏-Strecker工艺不同,该法通过一氯甲烷、三氯化磷和三氯化铝络合/解络的方法制备甲基二氯化膦(MDP),由MDP制备甲基亚膦酸二乙酯,后经Strecker反应、水解、胺化得到草铵膦铵盐(图1C)。该工艺减少了对设备的投资,综合成本较“格氏-Strecker工艺”低,但存在反应过程危险(原料三氯化磷易燃易爆)、“三废”问题严重(分离纯化困难产生大量固废和废水)等问题,已引起了环保部门的关注。该工艺相较于“格氏合成”的一个优势是前段工艺合成了MDP,待企业技术成熟后可灵活采用“热裂解-ACA工艺”的热裂解工艺合成MDP。
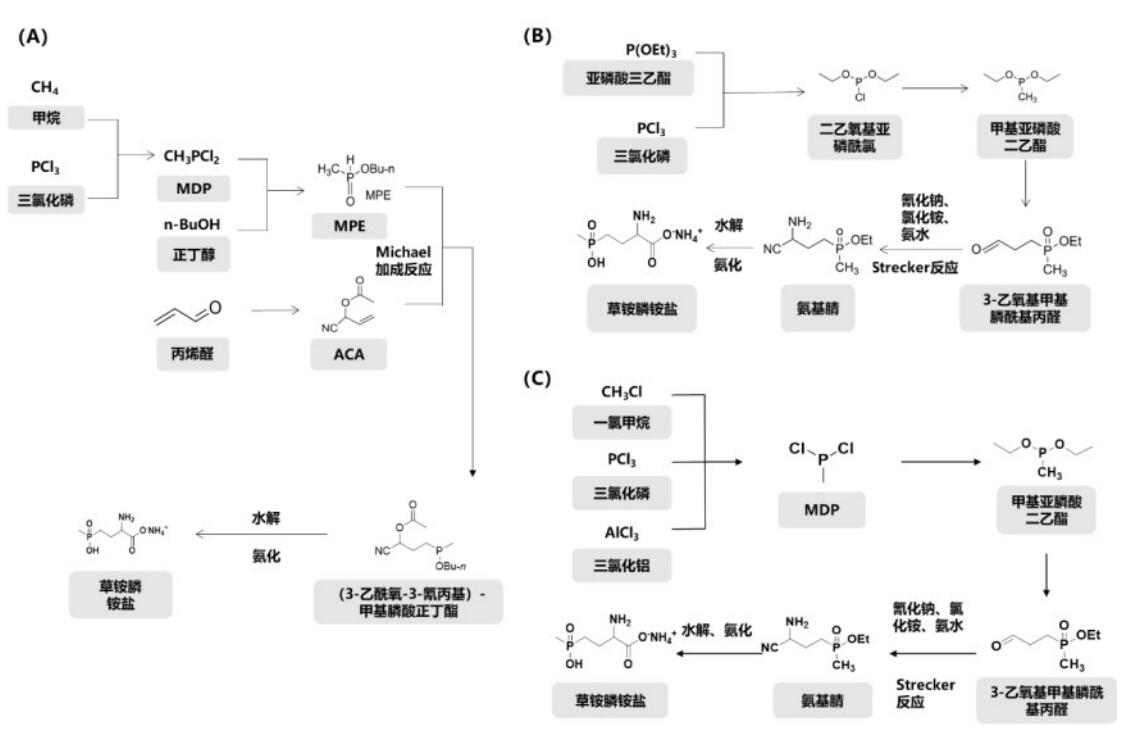
图1 3条草铵膦产业化生产路线
(A)热裂解-ACA工艺(简称“气相合成”);
(B)格氏-Strecker工艺(简称“格氏合成”);
(C)铝法-Strecker工艺(简称“铝法合成”)
1.4 D,L-草铵膦3种生产工艺比较
本文从连续化程度、工艺优劣势、“三废”排放、生产成本等方面对3种D,L-草铵膦生产工艺进行比较(表1)。总体而言,“气相合成”的生产连续性化程度高、“三废”排放少(环境友好)、成本具有优势,是3种工艺中最具竞争力的工艺路线。但是该工艺的实际难度较大,对反应装置的要求高,目前国内仅极少数企业具备该工艺生产能力。“铝法合成”与“格氏合成”合成草铵膦的工艺已日趋成熟,在多家企业实现产业化,但仍存在各种问题:① 与“气相合成”相比,“铝法合成”与“格氏合成”的产品收率较低,因此成本较高;②“铝法合成”与“格氏合成”工艺涉及化工产品多且流程复杂,大多数化工原料易燃易爆,存在安全隐患,尤其是格氏试剂和氰化钠,这2个工艺中的多个单元都需保证无水无氧的环境;③ Strecker反应合成路线较长,细分下来有蒸馏、精馏、过滤、离心等十几个操作单元,而每个单元都会产生相应的“三废”,较难处理,环保压力较大;④ 目前“铝法合成”与“格氏合成”工艺中的关键中间体甲基亚膦酸二乙酯纯度偏低,仅为70%;⑤ “铝法合成”与“格氏合成”工艺连续化程度低,而“气相合成”工艺已实现连续化生产,自动化程度高。
表1 D,L-草铵膦3种生产工艺比较*

2 L-草铵膦的生物制造
草铵膦以外消旋体形式上市以来,多国科学家在实验室水平研究其不同对映体的功效和毒性,发现D-草铵膦、L-草铵膦的除草能力差别巨大。笔者研究团队经过20多年研究,开发成功“高纯生物精草”,在中国生物农药之父沈寅初院士的指导下,建立了基于酰胺酶、脱乙酰基酶、氨基酸氧化酶、脱氢酶、还原胺化酶、酮酸转氨酶、腈水合酶、腈水解酶等生物催化技术以及从头合成的合成生物学技术制备L-草铵膦路线,成为当前有关L-草铵膦研发获得发明专利授权和学术论文发表最多的单位。2016年,浙江工业大学联合国内多家企业,利用生物法合成的高纯L-草铵膦、D-草铵膦,在海南省进行田间除草对比试验,在大田试验水平证明:1倍当量L-草铵膦能够达到2倍当量D,L-草铵膦用量的除草效果。这些研究为L-草铵膦的应用奠定了基础,揭示其良好的市场前景。因此,L-草铵膦的推广能够降低50%施药量,全球每年可直接减排数万吨的无效体(低效体)D-草铵膦,有效减轻农田耕作过程中无效化学物质的使用及对环境造成的负担,符合国家农药减量增效政策。
各国农药制造企业尝试开发了外消旋体拆分法、不对称合成法、天然氨基酸手性源法、手性辅助剂诱导等方法化学合成L-草铵膦,但由于立体选择性低、产物收率低、生产成本高等因素,始终没能进行大规模生产。例如,日本明治制果公司利用不对称Strecker反应、经酸性水解转化得到含氯离子的L-草铵膦,主要用于高档瓜果、花卉等经济作物的除草,改进L-草铵膦的化学合成,但由于产品生产成本高,含氯易引起土壤板结,很难大规模推广应用。
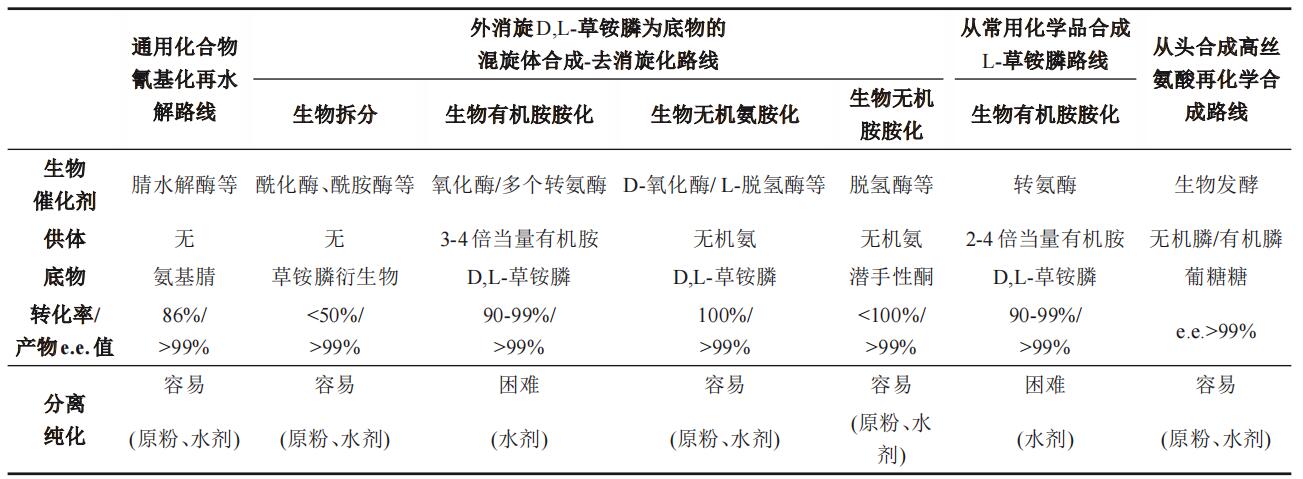
生物法合成L-草铵膦具有反应条件温和、立体选择性高等优点。笔者研究团队经过20多年的研究,与多家企业合作,开发了以下五大工艺路线与技术。路线1:混旋体衍生化—拆分路线;路线2:利用外消旋D,L-草铵膦为底物的混旋体合成—去消旋化路线;路线3:通用化合物氰基化再水解路线;路线4:从常用化学品合成L-草铵膦路线;路线5:从头合成高丝氨酸再化学合成L-草铵膦。下面就这些工艺路线进行详细分析。
2.1 混旋体衍生化—拆分路线
混旋体衍生化—拆分路线是生产氨基酸的常用工艺路线。生物拆分法的底物通常是氨基酸化学法衍生后的产物,利用酶催化拆分外消旋草铵膦衍生物得到光学纯氨基酸。针对L-草铵膦具体来说,可以从外消旋的草铵膦出发,制备(苯)乙酰化外消旋草铵膦,再以N-(苯)乙酰-PPT为底物,以高催化活力和高对映体选择性固定化酶为生物催化剂,进行动力学拆分合成得到光学纯的L-草铵膦(图2),固定化酶可以重复使用100次以上,使用成本低,企业无需建设大吨位的发酵产酶装置。但通常生物拆分法的最大理论转化率仅为50%,为了突破该限制,笔者研究团队开发了(苯)乙酰衍生化PPT新方法和针对D-N-(苯)乙酰-PPT的化学消旋法,从而构建了一种基于动力学拆分的L-草铵膦合成路线,在实际应用中产物得率大于90%,产物ee值>99%。
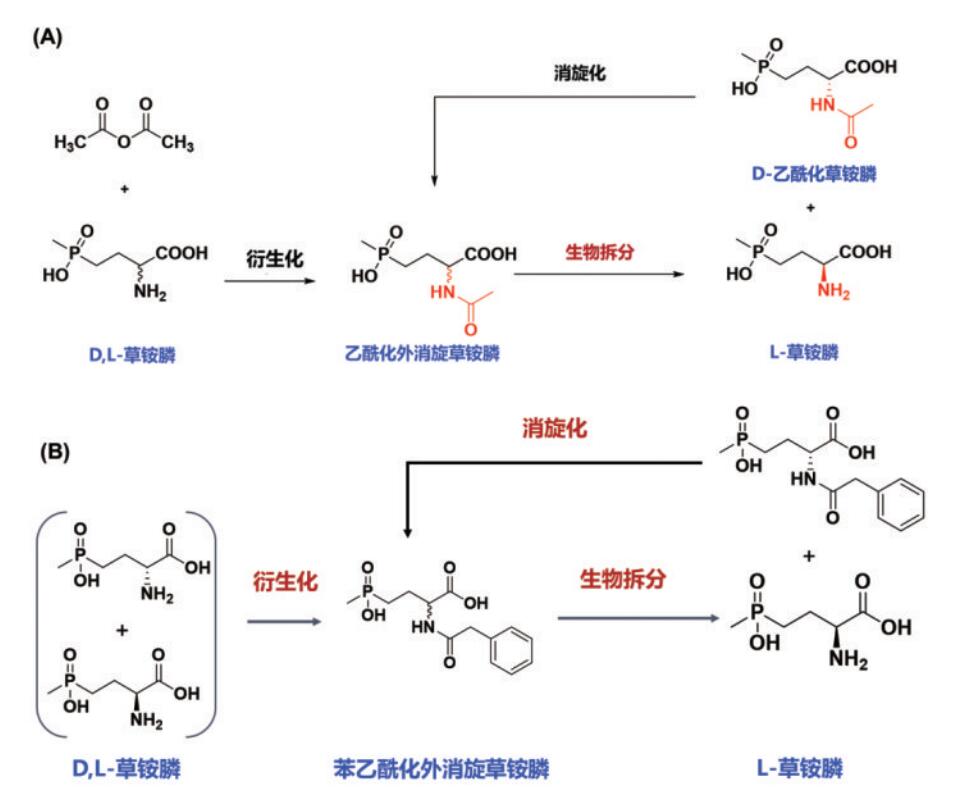
图2 混旋体衍生化—拆分路线示意图
(A)乙酰化外消旋草铵膦,再以乙酰-PPT为底物,动力学拆分合成得到L-草铵膦;
(B)苯乙酰化外消旋草铵膦,再以苯乙酰-PPT为底物,动力学拆分合成得到L-草铵膦
2.2 以外消旋D,L-草铵膦为底物的混旋体合成—去消旋化路线
该路线是在生产D,L-草铵膦后,通过生物拆分或生物去消旋等方法获得L-草铵膦。具体又可分为混旋体合成—生物氧化—生物有机胺胺化和混旋体合成—生物氧化—生物无机氨胺化两类。针对两类的共同步骤生物氧化,笔者研究团队开发了一种“通道—口袋”的理性分子改造工程,根据底物通过通道进入口袋的顺序进行突变热点的选取并依次进行迭代饱和突变,成功实现了D-氧化酶对酸性非天然底物的高效选择性氧化,并通过分子动力学模拟等手段为通道—口袋残基的突变如何控制底物结合并最终影响生物氧化效率提供新见解。
2.2.1 混旋体合成—生物氧化—生物有机胺胺化
生物氧化—生物有机胺化是生物去消旋合成L-PPT的有效方法,首先通过生物氧化选择性将外消旋草铵膦中的D-PPT转化为酮酸,同时保留另一半的L-PPT;然后再通过转胺反应将酮酸都转化为L-PPT。通过对氧化酶和转氨酶的筛选,这一路线已在国内外实验室和企业获得成功。笔者研究团队构建的生物氧化—生物有机胺化反应体系可实现D,L-PPT的完全去消旋化(转化率100%)。类似地,国内浙江大学、美国AgriMetis公司也开发了基于氧化酶和转氨酶的生物氧化—生物有机胺化催化技术,2020年9月,AgriMetis宣布将其Glu-L™除草剂的专利技术出售给巴斯夫。“生物去消旋”路线也可以利用双转氨酶实现,利用转氨酶I将D-PPT转化为酮酸,再利用转氨酶II不对称胺化酮酸到L-PPT。但是,基于转氨酶的生物有机胺化去消旋化技术都需要大量的有机胺供体(如丙氨酸、天冬氨酸、谷氨酸等)来推动反应的进行,并且很难达到100%的底物转化,并且这些胺供体的物化性质与L-PPT非常相似(如谷氨酸和L-PPT均为小分子酸性氨基酸),在工业上很难分离纯化。为此,浙江大学Zhou等人通过结合谷氨酸脱氢酶等酶开发了一个三酶级联反应系统。将副产物回收到氨供体L-谷氨酸中,同时使用醇脱氢酶进行辅酶再生,一定程度上减少了难分离的杂质量。
2.2.2 混旋体合成—生物氧化—生物无机氨胺化
如何能突破生物有机胺化的限制,利用廉价的无机氨作为氨基供体呢(图3)?为此,笔者研究团队发明基因挖掘新方法,发现、命名、解析了第一个草铵膦脱氢酶(率先解析了其晶体结构,PDB数据库登记号为8I83),发明“多性能协同进化”生物催化剂改造方法,通过分子改造等手段创制高活力、高选择性、高稳定性的工业催化剂,能高效生成L-草铵膦;并进一步发明工业适配负载型无机胺化催化剂,设计、组装和优化阐明反应模块,强化定向合成过程,时空产率创记录。建立了适配的辅酶自足型细胞工厂匹配定向合成过程,即使在高浓度底物条件下,多酶定向合成反应仍可以在短时间内转化完全底物。实现L-草铵膦的高效生产(底物转化率100%,无中间物残留,产物ee值近100%)。
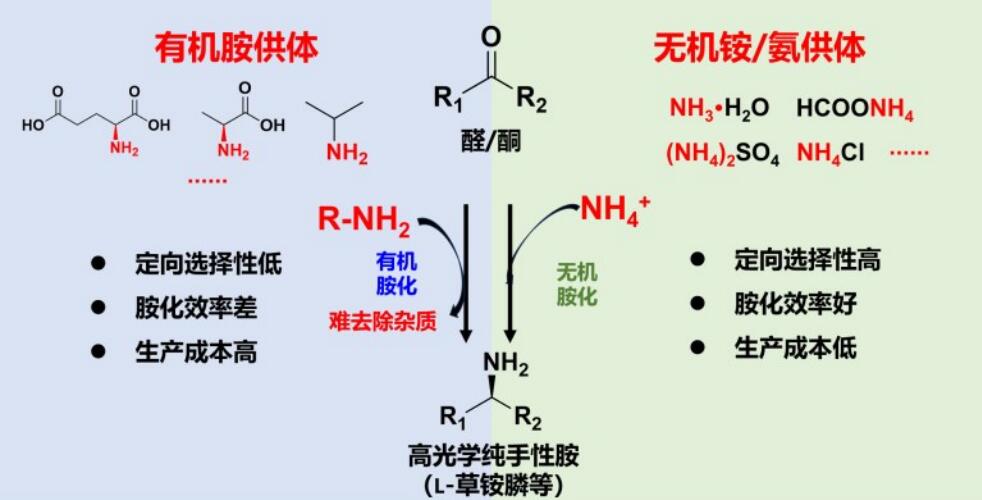
图3 生物有机胺化与生物无机胺化比较
2.3 通用化合物氰基化再水解路线
在D,L-草铵膦中,“格氏合成”和“铝法合成”都会生成共同的中间体α-氨基腈(即2-氨基-4-(羟乙基甲基磷酰基)-丁腈)。理论上立体选择性腈水解酶能转化α-氨基腈合成L-草铵膦酯,再通过酯水解就可以生产L-草铵膦(图4),是L-草铵膦合成的理想途径之一。笔者研究团队通过菌种筛选,获得了含有腈水解酶的粘质沙雷氏菌,以该菌作为生物催化剂,可以转化氨基腈生成L-2-氨基-4-(羟乙基甲基磷酰基)-丁酸酯,进一步通过酯水解或化学水解、铵化,可获得L-草铵膦铵盐。进一步,通过研究酶序列与解析腈水解酶失活机制,鉴定腈水解酶的底物—溶剂通道,对酶进行分子改造,增强其在工业环境下的活性和耐CN-、耐盐的稳定性;并进行化学合成氨基腈模块与生物合成L-草铵膦模块的对接,构筑了高强度L-草铵膦绿色生物制造工艺。
通过L-草铵膦的生物合成创新,结合笔者研究团队已完成的腈水解酶介导的R-扁桃酸和加巴喷丁的生物制造产业化工作。笔者研究团队阐明了选择性工业腈水解酶科学发现的方法学原理,发现了一系列高效选择性腈水解酶,建立了国际上种类最多的选择性腈水解酶工业酶库和菌种库。阐明了选择性腈水解酶理性设计的分子基础,通过创新腈水解酶“人工合成底物口袋结构重塑”等分子设计新方法,进化出迄今为止工业属性最强的选择性腈水解酶,服务于腈化合物的选择性水解。

图4 通用化合物氰基化再水解路线合成L-草铵膦路线图
2.4 从常用化学品合成L-草铵膦路线
该路线是一条创新的工艺路线,利用常规化学品开发草铵膦脱氢酶的新型底物,并结合创制的“草铵膦脱氢酶”及构筑辅酶再生体系,高效进行无机氨胺化反应生成高光学纯L-草铵膦(e.e.>99%)。进一步,针对多酶反应条件不匹配、动力学参数不匹配、蛋白表达不匹配,发明了多酶同步共进化策略,快速增加多酶耦合效率从30%提高到90%(图5)。为了提高氧化还原反应的辅酶供给,又进一步通过代谢途径改造,提高底盘细胞辅酶积累量设计并构建与还原胺化过程匹配的微生物底盘细胞,实现了生物合成与底盘细胞的高效匹配;并应用“从常用化学品合成L-草铵膦路线”,实现了底物到L-PPT的完全定量转化(转化率100%),且产物ee值近100%。
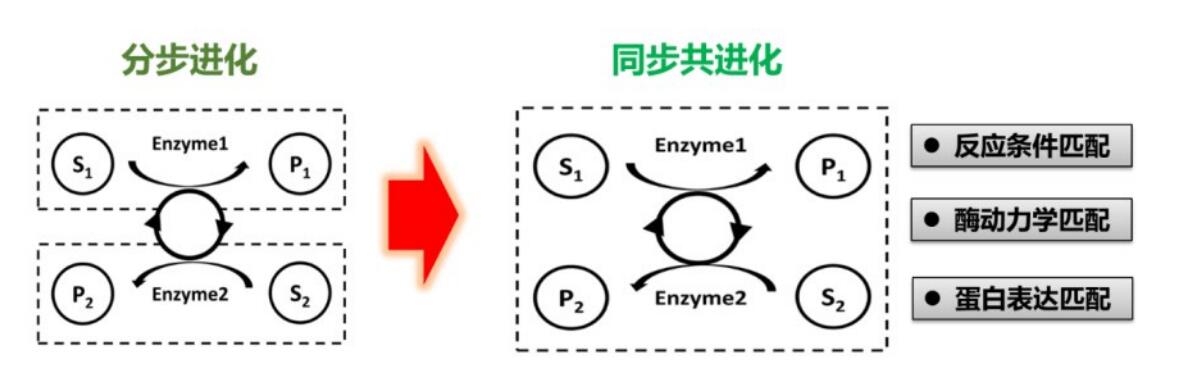
图5 多酶同步共进化策略示意图
2.5 从头合成高丝氨酸再化学合成L-草铵膦
以上的3条路线(混旋体衍生化—拆分、混旋体合成—氧化—胺化、通用化合物氰基化再水解)均直接或间接与D,L-草铵膦生产工艺对接,而生物制造L-草铵膦还可以通过发酵生产L-高丝氨酸后进行多步化学合成获得(图6)。因此,发酵法生产L-高丝氨酸成为近年来的研究热点。然而,利用生物法合成L-高丝氨酸仍存在一些不足之处,如发酵产量不高或糖酸转化率过低等。为此,国内外研究团队在底物利用、代谢途径中关键节点的改造、代谢途径中反馈抑制的解除、辅酶NAD(P)H的循环供应、产物外运系统的增强等方面已开展了大量研究工作。例如,中国科学院微生物研究所系统地分析了大肠杆菌中L-高丝氨酸的代谢网络,设计了一条由葡萄糖发酵高产L-高丝氨酸的辅酶平衡路线,构建了一株L-高丝氨酸高产菌株,在补料分批发酵中L-高丝氨酸产量达到84.1 g/L。笔者研究团队在敲除磷酸酶转移系统的大肠杆菌中引入半乳糖渗透酶系统(galP-glk系统),发现过表达galP,并且利用原位启动子替换将glk启动子替换为Ptrc启动子后,可以增强菌体对葡萄糖的利用率,稳定菌体生长,提高L-高丝氨酸产量,摇瓶中L-高丝氨酸产量提高了19%。而以蔗糖为底物发酵合成L-高丝氨酸的研究,在大肠杆菌中过表达蔗糖代谢基因scrA、scrB和scrK,发现菌株在摇瓶中的高丝氨酸产量提高3.4倍。
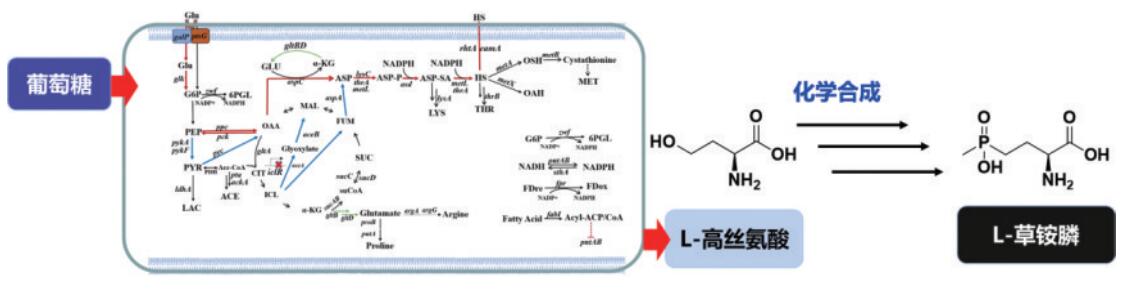
图6 从头合成高丝氨酸再化学合成L-草铵膦
2.6 L-草铵膦生产技术比较
涉及D,L-草铵膦与氨基腈的合成路线都是在现有D,L-草铵膦工艺上的进一步发展与衍生,因此这2种路线既对现有D,L-草铵膦/氨基腈工艺提出高要求,又要求后续生物制造过程简便、清洁、成本可控。根据成本计算和工艺分析,“气相合成”耦合“多酶定向合成技术”技术非常适合于有能力生产D,L-草铵膦的企业,可以合成高纯度L-草铵膦粉剂。浙江工业大学利用该技术实现D,L-草铵膦合成L-草铵膦的100%去消旋化。“从常用化学品合成L-草铵膦路线”需要创新化学工艺与“生物无机胺化”技术的对接。此外,“高丝氨酸”路线主要取决于高丝氨酸的发酵水平和后续化学合成的工艺,如何提高发酵过程中的糖酸转化率和发酵产量是其关键。
总体来说,L-草铵膦合成路线较多,技术含量高(表2)。所涉及到的酶很多,有腈水解酶、酰化酶、氧化酶、脱氢酶、转氨酶等,涵盖5大酶系;关键的胺化过程可以分为生物有机胺化和生物无机胺化,前者需要过量的有机胺,不利于分离纯化,而后者利用无机铵,具有很好的工业属性;再次,不同路线对应的底物不同,这对化学合成模块与生物合成模块的对接提出了很高的要求。
表2 L-草铵膦四大技术路线比较
3 辅酶再生体系的创新与发展
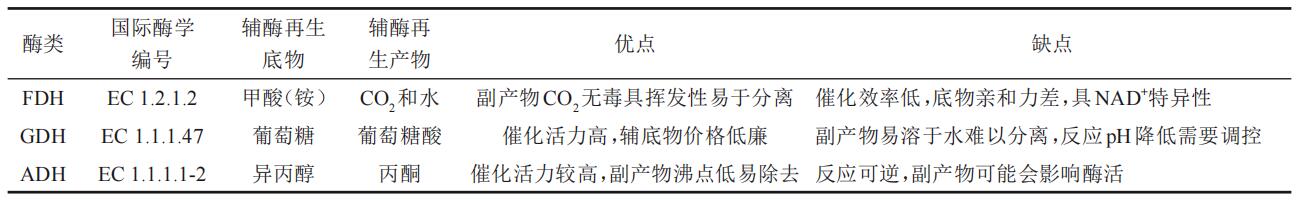
如果设计生物氧化还原反应合成L-草铵膦,则需要在反应体系中增加还原型辅酶NADH或NADPH提供还原力。考虑到成本问题,工业上不可能在反应体系中添加等化学计量的NAD(P)H,构建高效的辅酶循环系统来替代辅酶的大量添加,是很好的解决途径。在酶法、光化学法、电化学法和化学法等4种方法中,酶法具有效率高、环境友好、选择性高等特点,被广泛应用于生物制造过程中辅酶NADH/NADPH的再生。主要有3种酶,即葡萄糖脱氢酶(GDH)、甲酸脱氢酶(FDH)和醇脱氢酶(ADH),基于这3种酶的辅酶循环系统特点总结于表3。葡萄糖脱氢酶是一种短链脱氢酶,为同源四聚体,存在于细菌和古细菌中,其优势在于其底物葡萄糖价格低廉,且该酶催化效率高,对NAD+和NADP+均有活力;葡萄糖脱氢酶辅酶再生系统在催化过程中不断将葡萄糖氧化为葡萄糖酸,致使体系的pH下降,故需在反应过程中调节pH;其次,要获得高纯度的L-草铵膦原药,需要去除用GDH引入的副产物葡萄糖酸,需要进一步进行分离纯化。FDH主要来源于细菌、酵母与植物,其优势在于其能够利用无毒害的甲酸作为NADH再生的氢供体,且甲酸盐的氧化反应不可逆,副产物CO2具挥发性,很容易从生物反应体系排出,避免后续副产物的分离。甲酸脱氢酶辅酶再生系统的主要限制因素是其催化性能较低(大多数天然FDH的kcat/Km<10 mM−1s−1)、底物亲和力较差(Km>10 mM)、对于NADP+的特异性差((kcat/Km)NADP+/(kcat/Km)NAD+,通常低于30),因而应用受到限制。笔者研究团队通过解析甲酸脱氢酶辅酶选择性、酶活、稳定性机制,利用“祖先序列重构”“多性能协同进化”等手段,创制了高选择性、高酶活、高稳定性的甲酸脱氢酶,克服了“鱼和熊掌不可兼得”的“trade-off”效应,建立了适合高光学纯L-草铵膦等手性氨基酸合成的生物催化体系。ADH能够可逆地催化醛和酮选择性还原为伯醇和仲醇,主要应用于酮类的不对称还原,但氧化反应也有报道。醇脱氢酶通常将异丙醇作为辅酶再生的底物,将其氧化为丙酮,同时将NAD(P)+还原为NAD(P)H。其优势在于其底物异丙醇经济易得,且副产物丙酮沸点低,易于除去;但由于反应可逆,需添加过量的底物来促进反应进行,高浓度的有机溶剂虽然一定程度上可以助溶,但却可能抑制反应体系中其他酶类的活性。
从上述分析中,我们可以发现L-草铵膦的生物制造涉及的反应类型有腈化、水解、脱胺、转胺、加成、缩合、拆分、氧化、还原、取代;生物催化剂有耐CN-腈水解酶、水合酶、酰胺酶、酰化酶、脱乙酰基酶、氨基酸氧化酶、草铵膦脱氢酶、还原胺化酶、酮酸转氨酶、腈水合酶等多品种酶的级联和耦合;而工业化装备更是包括高密度生物发酵罐、陶瓷膜、氧气循环反应装置、酶膜反应器;连续流微通道反应器、连续流管式反应器、连续流釜式反应器等,是一个综合创新的集中体现。进一步,因为草铵膦的需求量大,无论采用生物酶/细胞催化还是发酵介导的L-草铵膦生物制造方式都需要进行吨级发酵。笔者研究团队通过发酵模式和诱导方式的创新,增加单细胞内多酶可溶性表达量;提出了pH恒定补料反馈补料发酵策略,过程更具成本和环保优势;在5吨、50吨发酵罐上实现多基因共表达工程菌的规模化发酵生产,催化剂单位体积酶活和L-高丝氨酸的糖酸转化率均达到文献报道最高水平。
表3 辅酶再生酶的分类及特点
4 展望
D,L-草铵膦作为外消体已经上市近30年,随着百草枯的禁用和耐草铵膦转基因作物的推广,其市场前景被不断看好。根据实验室和大田试验的结果表明:绝大部分除草活力来自于L-草铵膦,而D-草铵膦基本没有除草活性,是一种环境负担物质。随着草铵膦用量的增加,每年可能会有几万吨的D-草铵膦污染。因此,发展L-草铵膦替代D,L-草铵膦对我国农药实现增效减量将起到极大的推动作用。而生物制造技术以其特有的高立体选择性、反应条件温和等特点,吸引了众多科技工作者开发L-草铵膦生物制造技术。目前已形成多种工艺路线,其中,利用外消旋D,L-草铵膦为底物的混旋体合成—去消旋化路线适用于已掌握了“气相合成”D,L-草铵膦的企业,成本低,“三废”排放少,产品对土壤友好,具有很强的市场竞争力;而从头合成L-草铵膦则比较适合于合成生物相关企业。因此,笔者认为这4条路线在不同类型企业会展示出不同的潜力,真正实现大规模工业化后,究竟那条路线的成本和环保优势最明显,需要充分考虑底物/中间体合成成本、底物/中间体和辅底物的回收利用、酶活力和立体选择性、产物分离纯化、副产物的回收利用、生产线的数字智能化控制水平等方面的综合因素。
笔者研究团队进行20多年单一高活性手性农药的创制研发,开发了三代农药手性生物合成技术,可喜的是合作企业根据自身基础,建成了各具特色、数字智能化控制水平高的年产万吨级高光学纯手性农药L-草铵膦的生产线,开发了三维参数传感联动技术,解析工程放大规律;研究工业反应体系下微环境、能量流、物质流对多酶催化反应过程放大的影响规律,优化大型反应器流场分布,提高生产效率;利用智能传感器和执行器,实现超千个控制点的实时数据采集、传输、分析和反馈调节,全自动化参数采集与控制生产效率提高50%,降低劳动强度降低70%以上。推动了国内众多农药龙头企业的手性农药登记,也促进了系列手性农药产品标准的制定,提升了我国精细化学品的生产制造水平。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。