
害虫种类繁多,危害极大,每年都造成巨大的经济损失。
目前,化学农药在害虫防治领域仍然发挥着重要的作用,然而害虫抗药性的发展不可避免地导致农药的用量和使用次数不断增加,进而带来农药残留超标、环境污染和害虫抗药性进一步加剧等一系列问题。因此,在农业生产实践中,需要不断研发绿色安全、高效的新型农药。
1 RNA生物农药
RNA生物农药又称核酸生物农药、核酸干扰素,通过靶标生物体内天然存在的RNA干扰(RNA interference,RNAi)通路,干扰或抑制靶标生物特定基因转录或表达的多核苷酸制剂。RNAi是真核生物中由RNA诱发,引起与之配对的mRNA高效特异性降解从而降低靶标基因表达的一种生物学现象,在进化过程中高度保守。
RNAi主要由dsRNA/小干扰RNA(small interfering RNA,dsRNA/siRNA)、微小RNA(microRNA,miRNA)和P转座子诱导互作RNA(P-elementinduced wimpy testis interacting RNA,piRNA)这3个通路调控,详见图1。这些RNA的共同特点是在生物体内不表达蛋白质,而是在RNA水平上通过不同的通路行使各自的生物学功能。
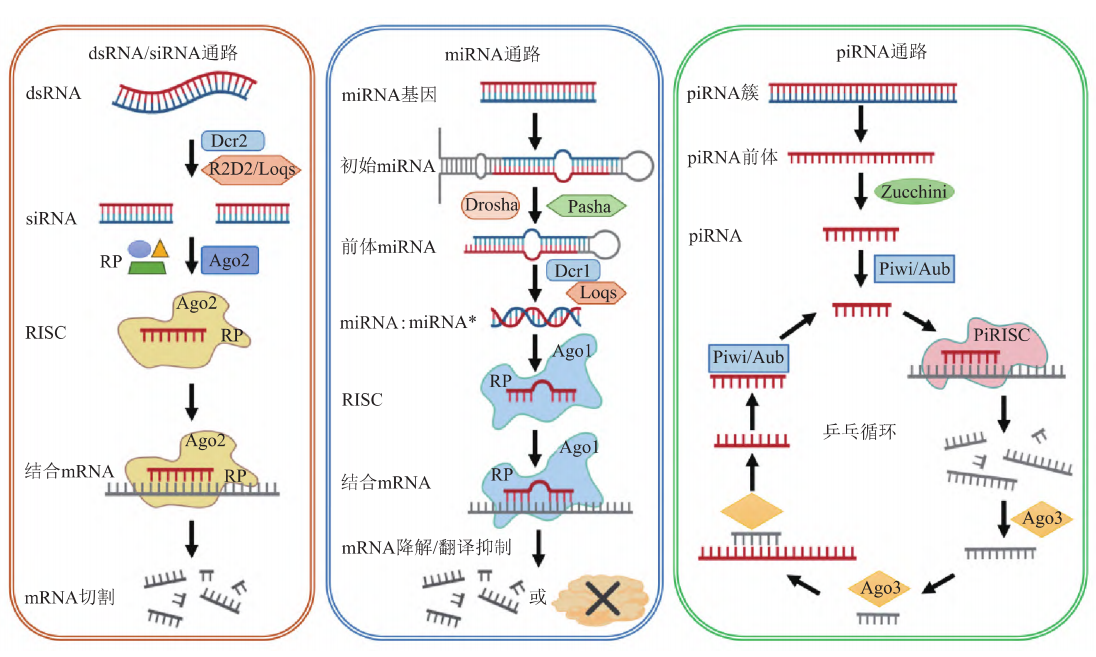
图1 RNA干扰的3种通路
2 RNAi不同通路的作用机制
2.1 DsRNA/siRNA通路
长链dsRNA在RNA聚合酶Ⅲ中Dicer2酶的作用下被切割为长度为9~21 nt的siRNA,siRNA在Dicer2及其协助蛋白R2D2的帮助下,将其传递给其他相关蛋白Argonaute(Ago2)等,最终形成“siRNA诱导的沉默复合体”(siRNA induced silencing complex,siRISC)。SiRNA在Ago2的作用下解离为2条单链,RISC被激活,通过碱基互补配对的原则识别靶标mRNA,由Ago2切割与靶标mRNA碱基互补的序列,从而导致靶标基因快速和持续性沉默。
2.2 MiRNA通路
微小RNA是一类长19~23 nt的内源性非编码单链RNA分子。绝大多数miRNA的转录是由RNA聚合酶Ⅱ介导,少数由RNA聚合酶Ⅲ介导,形成长度为几百甚至上千个碱基的初始转录本(pri-miRNA),在RNaseⅢ的作用下,pri-miRNA在细胞核中被剪切生成miRNA前体(pre-miRNA),然后由转运蛋白expotin-5从细胞核转运到细胞质中,进一步被Dicer酶切割成为双链(miRNA∶miRNA*),即成熟的miRNA和其互补序列miRNA*。最终,成熟的miRNA与其他相关蛋白质包括TRBP和Argonaute蛋白(Ago1)等结合,形成“miRNA诱导的沉默复合体”(miRNA induced silencing complex,miRISC)。MiRISC在miRNA的引导下通过碱基互补配对原则识别靶标基因,并与之结合,对靶标基因进行特异性降解或抑制,进而调控基因的表达。
2.3 PiRNA通路
PiRNA是一类长度为26~31 nt的非编码RNA,最早在小鼠精巢里发现,因其主要与Piwi亚家族蛋白相互作用,所以被命名为PiRNA。PiRNA与miRNA、siRNA虽然同属于一类成熟体序列长度小于200 nt的非编码RNA,但其与siRNA和miRNA又有不同之处:① PiRNA途径是动物所特有的,主要在生殖细胞中表达;② PiRNA形成成熟体的过程与Piwi亚家族蛋白(Ago3、Piwi、Aub)密切相关,而不依赖于Dicer酶的作用;③ 通过piRNA通路形成的piRNA在3'端有甲基化修饰,但PiRNA的作用机制尚有待深入研究。
3 RNA生物农药在害虫防治领域的研究进展
RNA生物农药具有防治靶标范围广、应用方便、易于操作、绿色无污染、无残留及环境兼容性强等众多优势,为研发新的绿色可持续害虫防治方法提供了新的机会,被称为“农药历史上的第3次革命”。RNAi在害虫防治方面的应用主要分为2种:① 植物源保护剂(plant-incorporated protectant,PIP),通过转基因方法将具有杀虫活性dsRNA/miRN转入植物,进行害虫防治;② 非植物源保护剂(non-plant-incorporated protectant,non-PIP),制备dsRNA/miRNA制剂,利用喷洒、灌根或浸种等方式进行害虫防治。在害虫防治领域,RNA生物农药的研究主要集中于dsRNA,miRNA生物农药的研究应用还处于起步阶段,而piRNA生物农药的研究几乎没有。因此,这里主要介绍dsRNA和miRNA生物农药在害虫防治领域的研究进展。
3.1 DsRNA生物农药的研究进展
3.1.1 DsRNA植物源保护剂在害虫防治领域的研究
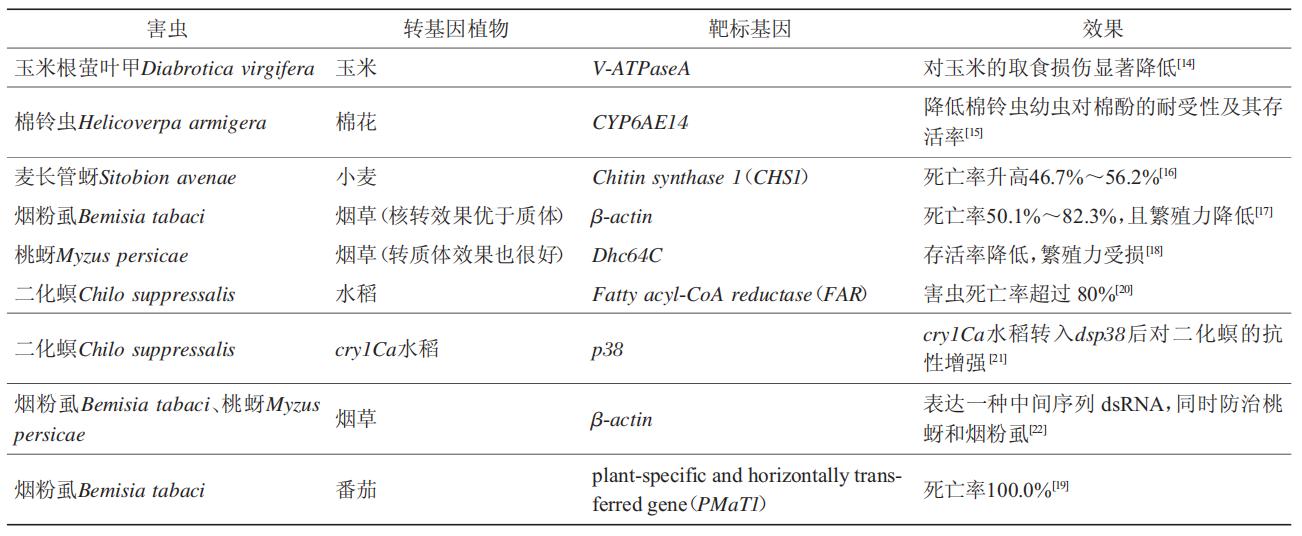
植物源保护dsRNA在害虫防治方面的研究已有很多(表1)。表达玉米根萤叶甲Diabrotica virgifera的dsV-ATPaseA玉米能够显著抑制玉米根萤叶甲的生长发育,玉米根萤叶甲死亡率显著升高,转基因玉米植株的取食损伤显著降低。在棉花中表达棉铃虫Helicoverpa armigera细胞色素P450(CYP6AE14)的发夹结构RNA(hairpin RNA,hpRNA),能大大降低棉铃虫幼虫对棉酚的耐受性,降低其存活率;随后,dsRNA转基因作物防治害虫的案例越来越多,如表达Chitin synthase1(CHS1)的转基因小麦使麦长管蚜Sitobion avenae的死亡率升高46.7%~56.2%;表达β-actin或Dhc64C的转基因烟草对烟粉虱Bemisia tabaci或桃蚜Myzus persicae也有很好的防效。转基因番茄中表达烟粉虱基因组中一个植物特异性水平转移基因BtPMaT1的dsRNA,导致烟粉虱最终死亡率几乎达到100%;此外,表达BtPMaT1基因的番茄还能有效减少烟粉虱的为害。二化螟Chilo suppressali取食表达Fatty acyl-CoA reductase双链(dsFAR)的水稻后致死率在80%以上。除了一价的转基因抗虫植物,二价及多价的转基因抗虫植物的研究也有了新的进展,比如在表达苏云金杆菌(Bacillus thuringiensis,Bt)的cry1Ca水稻中转入靶向二化螟p38基因的dsRNA,能大大提高cry1Ca水稻对二化螟的抗性。最新研究发现,采用错配核苷酸间隔纠错的dsRNA设计理念,可以有效拓展植物介导RNAi技术的杀虫谱,从而达到“一箭双雕”的害虫防治模式。
表1 DsRNA植物源保护剂在害虫防治领域的研究
3.1.2 DsRNA非植物源保护剂在害虫防治领域的研究
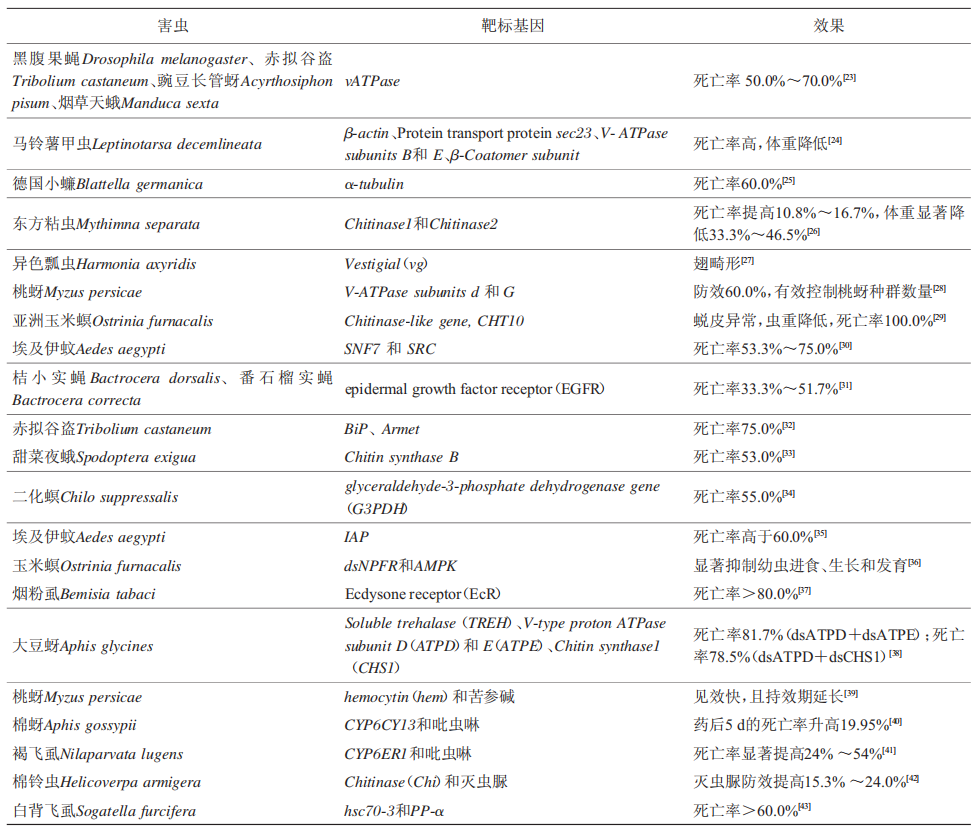
基于dsRNA的RNA农药通过喷洒、灌根或浸种等方式在害虫防治领域同样具有很大的潜力(表2)。比如,体外合成vATPase的dsRNA,饲喂黑腹果蝇Drosophila melanogaster、赤拟谷盗Tribolium castaneum、豌豆长管蚜Acyrthosiphon pisum和烟草天蛾Manduca sexta后,害虫的死亡率为50.0%~70.0%。为了降低dsRNA的生产成本,科研工作者通过HT115-L4440原核表达系统大量生产dsRNA,对马铃薯甲虫Leptinotarsa decemlineata同样具有良好的致死效果,该研究首次报道了细菌表达dsRNA诱发RNAi效应导致害虫的死亡。此后,该原核表达系统广泛应用dsRNA生物农药的制备和防效检测中,比如德国小蠊Blattella germanica取食体外表达dsα-tubulin的死亡率达60%;东方粘虫Mythimna separata取食dsChitinase1和dsChitinase2后虫重降低,死亡率升高10.8%~16.7%。也有研究发现,pET28-HT115原核表达系统也能高效表达dsRNA,并用于害虫防治。
表2 DsRNA非植物源保护剂在害虫防治领域的研究
随着研究的深入,发现传统的dsRNA递送系统会因为环境因素以及害虫体内环境的影响导致RNAi效率降低,而壳聚糖、脂质体和星状阳离子聚合物(SPc)等纳米颗粒递送dsRNA能大大提高RNAi效率。例如,与单独饲喂dsEcR相比,壳聚糖搭载dsEcR使烟粉虱死亡率高于80%;SPc可以携带dsRNA穿透大豆蚜Aphis glycines体壁,致死率可达78.5%;田间试验中,SPc携带dsV-ATPase-d对桃蚜的防效达60.0%。
为了进一步减少化学杀虫剂的使用,同时提高对害虫的防效,越来越多的研究聚焦于杀虫剂、纳米载体和dsRNA的联合应用。苦参碱/SPc/dshem复合物的使用不仅加速了苦参碱对桃蚜的防效,还延长了其持效期。与单独使用吡虫啉相比,RHMS/吡虫啉/dsCYP6CY13复合物对棉蚜Aphis gossypii的毒力显著提高了1.95倍;吡虫啉/dsNlCYP6ER1@ZIF-8复合物使褐飞虱Nilaparvata lugens的死亡率显著升高了24%~54%。
3.2 MiRNA生物农药的研究进展
MiRNAs作为调节基因表达的关键因子,几乎参与昆虫所有生理和生化过程,包括蜕皮和变态、繁殖、免疫、翅的发育以及抗药性,对昆虫的生长和发育至关重要。特定miRNAs的异常表达往往会使昆虫生长发育严重受阻,甚至导致死亡,这也暗示了miRNAs具有作为RNA生物农药防治害虫的潜能。然而,miRNA生物农药的研究进程远远落后于dsRNA生物农药。
3.2.1 MiRNA植物源保护剂在害虫防治领域的研究
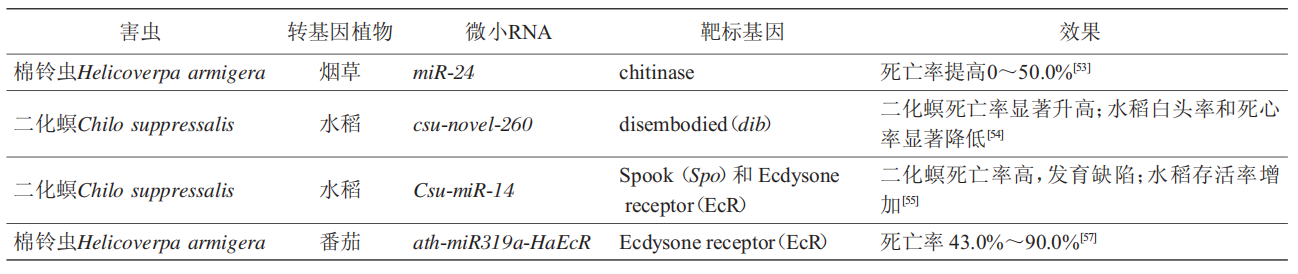
通过miRNA转基因植物来防治害虫的研究相对较少(表3)。2015年,Agrawal等研究发现,棉铃虫取食表达miR-24的烟草叶片后死亡率显著提高。在水稻中分别表达靶向二化螟蜕皮激素受体(ecdysone receptor,EcR)的miR-14和csu-novel-260,二化螟取食后存活率显著降低,水稻分蘖期的死心率和抽穗期的白头率也大大降低。2021年,Yogindran等在番茄中表达amiRNA-HaEcR,结果表明,转基因番茄对棉铃虫表现出较高的抗性。中国农业大学研究团队分别构建表达了Pxy-miR-34转基因拟南芥和油菜,3种鳞翅目害虫取食后的死亡率为94.1%~100.0%。以上结果表明,通过构建miRNA转基因作物可用于防治害虫,甚至可以达到“一苗多防”的害虫防治模式。
表3 MiRNA植物源保护剂在害虫防治领域的研究
3.2.2 MiRNA非植物源保护剂在害虫防治领域的研究
MiRNA非植物源保护剂在害虫防治领域的研究也有了一定的进展(表4)。2016年,Yogindran等以斜纹夜蛾Spodoptera litura内源miRNA(let-7)为骨架表达靶向棉铃虫EcR的dsRNA(amiRNA-HaEcR),棉铃虫取食amiRNA-HaEcR后死亡率明显升高,繁殖能力大大降低。该研究虽然没有直接表达昆虫内源miRNA,但是为后续内源miRNA的体外表达提供了借鉴。2022年,埃及伊蚊Aedes aegypti的miR-8和miR-375在白僵菌Beauveria bassiana中成功表达,该白僵菌对埃及伊蚊的致病力明显增强,并加速了埃及伊蚊的死亡,这种基于病原体的RNAi为真菌杀虫剂防效的提高提供了一种新的策略。
表4 MiRNA非植物源保护剂在害虫防治领域的研究
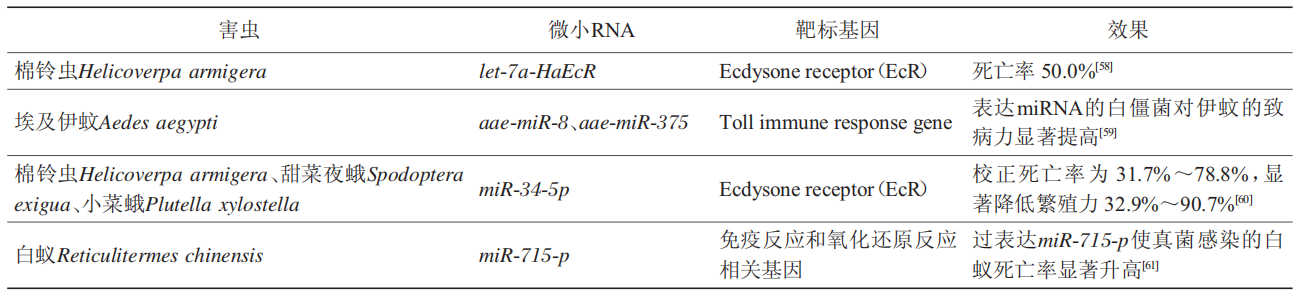
中国农业大学对miRNA生物农药也进行了系列的研究,结果表明,鳞翅目害虫棉铃虫、甜菜夜蛾Spodoptera exigua和小菜蛾Plutella xylostella取食miR-34-5p的类似物agomir-34和抑制剂antagomir-34后累积校正死亡率分别为31.7%~63.6%和44.1%~75.6%,繁殖力显著降低了32.9%~43.8%和38.4%~47.6%。并通过原核系统表达了小菜蛾内源miR-34-5p(amiR-34),3种鳞翅目害虫取食amiR-34喷雾处理盆栽小白菜和玉米后,幼虫死亡率为81.7%~90.8%。这也是首次实现了利用一种害虫的内源miRNA同时防治多种鳞翅目害虫的“一药多防”绿色害虫防治模式。这为进一步发展基于miRNA的绿色害虫控制策略奠定了重要基础。
4 RNA生物农药的商品化进展
RNA生物农药在害虫防治领域的商品化应用同样包括植物源和非植物源保护剂,目前均有商品化产品。在植物源保护剂方面,孟山都公司(现拜耳)的新一代转基因玉米MON87411同时表达了Bt蛋白Cry3Bb1、耐除草剂基因CP4-EPSPS和靶向玉米根萤叶甲Snf7的dsRNA,该玉米2017年获得美国环境保护署(US Environmental Protection Agency,EPA)的批准,随后在阿根廷、巴西、加拿大和美国获得种植许可。MON87411是国际上首例在植物中表达dsRNA的产品。2021年1月21日,拜耳宣布该产品获得中国农业农村部颁发的转基因生物安全证书,2022年在美国进行商业化种植,2023年在加拿大进行推广。2021年2月9日,澳新食品标准局(Food Standards Australia New Zealand,FSANZ)批准美国科迪华公司的抗虫和耐除草剂玉米产品DP23211用于食品,该玉米同时表达靶向玉米根萤叶甲DvSSJ1基因的dsRNA和IPD072Aa蛋白,能有效防治玉米根萤叶甲。
令人兴奋的是用于害虫防治的喷洒型RNA生物农药ledprona于2023年12月22日获得了EPA的正式批准。Ledprona是美国GreenLight Biosciences公司开发的靶向马铃薯甲虫蛋白酶体β5亚基(PSMB5)的dsRNA杀虫剂,主要活性成分是dsPSMB5,通过抑制PSMB5的表达来防治害虫。使用0.8%的dsPSMB5制剂处理马铃薯甲虫2龄幼虫,药后6 d致死率高达90%,且dsRNA用量仅需4 g/hm2。这是世界上第1个商业化的喷洒型dsRNA生物农药(https://www.epa.gov/pesticides/epa-registers-novel-pesticide-technology-potato-crops)。此外,上海硅羿科技有限公司获得了国内最早颁发的4张RNA生物农药“核酸干扰素”命名函,其中研发的第1个烟草花叶病毒核酸干扰素SG-RNA001已正式进入农药登记田间试验阶段,杀虫剂、种衣剂也在陆续申请中。RNAissance Ag LLC也在积极开发针对小菜蛾的喷雾式RNA生物农药。
目前,RNA生物农药在害虫防治领域的商品化有了很大的突破,但是到目前为止RNA生物农药的产品主要是基于dsRNA,miRNA相关的生物农药还没有商品化产品。这主要是miRNA用于害虫防治的研究起步较晚,但是近2年miRNA已经陆续进入大家的视野,相信在不久的将来就会有miRNA生物农药产品的出现。
5 DsRNA和miRNA生物农药的异同点
DsRNA和miRNA生物农药的相同点:① DsRNA和miRNA均是非编码RNA,在生物体内不表达蛋白质,都通过负调控靶标基因的表达来防治害虫。② 都可以通过植物源保护剂和非植物源保护剂这2种方式用于害虫防控。
DsRNA和miRNA生物农药的不同点,表现在6个方面:
(1)来源不同:dsRNA生物农药是利用害虫靶标基因人为设计200~500 nt的RNA序列,并不是害虫内源基因;而miRNA生物农药是利用害虫内源性的、对其生长发育十分关键的miRNA来防治害虫。
(2)作用效果不同:一般来说,1种dsRNA只能调控1个靶标基因的表达,且具有物种特异性;而miRNA对靶标基因的调控十分复杂,单个miRNA可以调控数百个不同基因的表达,1个靶标基因也可能受到多个miRNA的共同调控。
(3)害虫防治谱不同:dsRNA生物农药一般是“一药一防”;而miRNA生物农药对害虫的防治具有广谱性,能实现1种miRNA同时防治多种害虫的“一药多防”的害虫防治模式。
(4)研究进展不同:dsRNA生物农药的研究更加深入,目前已经拥有了商业化产品,如转基因玉米MON87411、DP23211,以及喷洒型dsRNA生物农药ledprona;MiRNA的相关研究大多集中在其功能上,miRNA作为生物农药的研究在近几年才得到广大学者的重视,所以到目前为止还没有商品化的miRNA生物农药。
(5)脱靶效应:外源dsRNA进入害虫体内先降解产生siRNA,而siRNA的序列不确定,可能导致脱靶效应,且这种脱靶效应很难预测。MiRNA本身序列较短,因此不存在这方面的风险。
(6)抗药性:dsRNA易产生靶标抗性,miRNA产生靶标抗性的几率更低,昆虫不会明确地选择对其内源性miRNA产生抗药性。然而因靶器官(主要是肠道)细胞对RNA吸收能力的改变而产生的抗性,dsRNA与miRNA应该无太大差别。
6 结论与展望
RNA生物农药具有防治靶标范围广,开发成本低,绿色安全等众多优势,有望实现农产品质量安全、生态安全和环境安全等各种需求,非常符合当今社会的要求,是一种具有巨大开发及应用潜力的新型绿色生物农药。目前,已拥有商品化产品转基因玉米MON87411和DP23211,以及喷洒型dsRNA生物农药ledprona。然而,为了确保RNA生物农药的可持续研发与应用,还必须解决好以下2个关键的问题。
6.1 害虫对RNA生物农药的抗性
在害虫防治领域,尽管RNA生物农药相对于传统化学农药和转基因Bt(Bacillus thuringiensis)作物拥有其自身独特的优势,然而,不可否认的是,与化学农药和转基因Bt作物一样,害虫超强的适应能力使其仍有可能对RNA生物农药产生抗药性。害虫对RNA生物农药产生抗性的方式有2种:① RNAi中靶标基因的表达量下调或突变;② 靶器官(主要是肠道)细胞对RNA的吸收效率降低。此前已有报道,玉米根萤叶甲、马铃薯甲虫和林业害虫柳蓝叶甲Plagiodera versicolora均在实验室条件下通过dsRNA的持续筛选,对dsRNA抗性显著增加。与敏感品系相比,抗性品系肠道组织对dsRNA的吸收能力显著降低。因此,在实际应用过程中,RNA生物农药最好与其他害虫防治手段(如化学杀虫剂或生物杀虫剂)联合使用,这种多策略联合使用的方法不但可以提高对害虫的防治效果,还能降低杀虫剂对害虫的选择压,从而降低抗性发展的风险。
6.2 RNA生物农药的脱靶效应
RNA生物农药如果存在脱靶效应,可能会对传粉昆虫和天敌昆虫等有益昆虫造成潜在的威胁,同样会限制其在害虫防治中的应用。因此,在RNA生物农药的研发初期就要严格把关,严格规避潜在的脱靶效应。首先,对于dsRNA来说,设计初期要进行深入的、系统的生物信息学分析,设计高度特异和保守的dsRNA,同时还应考虑dsRNA降解为siRNA造成的脱靶效应,从而避免其对非靶标物种的危害;对于miRNA来说,要严格筛选昆虫特有的miRNA,并通过miRNA靶标预测软件全面系统地预测其靶标结合位点,筛选掉可能靶向有益昆虫或哺乳动物重要基因的miRNA。其次,在RNA生物农药毒力检测过程中,也要检测其对非靶标生物的毒力,进而为RNA生物农药的实际应用奠定良好的基础并提供保障。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。