
原标题:国外转基因作物上草按滕登记残留风险评估进展

伴随着抗草铵膦转基因作物在全球范围内的大面积种植,据2020年的统计数据,草铵膦已成为全球第二大除草剂产品。我国目前制定了一系列相关的法律法规、管理政策及技术规则,逐步建立和完善了转基因作物研究、试验、生产、加工、经营、进口许可、产品标识等环节的全流程监管体系,但关于农药在转基因作物上使用后的残留登记评价尚未开展系统深入的研究。
本文以草铵膦为对象,系统梳理和分析了联合国粮农组织/世界卫生组织(FAO/WHO)农药残留专家联席会议(JMPR)、欧盟欧洲食品安全管理局(EFSA)、美国环境保护署(U.S. EPA)以及日本药事和食品卫生委员会(PAFSC)关于转基因作物上草铵膦登记的残留风险评估,以期为我国农药在转基因作物上的残留登记评价和风险评估提供参考。
1 草铵膦在转基因作物上的残留化学评估
1.1 植物中的代谢
伴随着转基因技术的发展,草铵膦在转基因植物上的代谢途径和产物也发生了一系列变化,各国际组织、国家和地区首先对草铵膦在转基因作物上的植物代谢进行了评估。
1.1.1 JMPR
1991年和1994年,JMPR在评估草铵膦时尚未涉及转基因作物,JMPR当时认为其主要残留物为草铵膦与3-(甲基膦基)丙酸(3-methyl-phosphinico-propionic acid,MPP),并推荐残留定义为“草铵膦母体与3-(甲基膦基)丙酸的总和,以草铵膦表示”。
1998年,JMPR第1次对转基因作物中草铵膦的代谢行为进行了评估,表明在多种转基因作物中N-乙酰-草铵膦(N-acetyl-glufosinate,NAG)成为了主要的代谢产物。使用含草铵膦(已用14C标记)的营养液分别培育转基因油菜和非转基因油菜,6 d后,转基因油菜中NAG占到了57%,草铵膦仅占36%;而在非转基因油菜中,草铵膦占到了80%,MPP占16%。表明草铵膦在转基因油菜中发生了乙酰化反应,代谢生成了NAG。在转基因甜菜中,NAG占叶片和根部中残留物的67%和68%,草铵膦只占了24%和19%,MPP则只有2.7%和6%。在转基因玉米代谢试验中,草铵膦是次要残留物,在鲜秸秆(forage)、青贮饲料(silage)和秸秆饲料(fodder)中主要残留物均为NAG,在玉米(grain)、玉米棒(cobs)和玉米苞片(husks)中主要残留物为MPP。在转基因大豆中,饲料(forage,推测主要为大豆植株)、秸秆、青豆(带荚)、大豆中,NAG均是最主要的残留物,分别占大豆和饲料中残留物的61%和60%。
此外,1998年JMPR的报告中还指出,草铵膦是含有L-与D-对映异构体的外消旋体,L-草铵膦是其活性成分,是潜在的谷氨酰胺合成酶抑制剂,而D-草铵膦无除草活性。在植物体内主要是L-草铵膦发生了降解,生成N-乙酰基-L-草铵膦(N-acetyl-L-glufosinate),而D-草铵膦较为稳定。
1.1.2 欧盟
2015年EFSA的评估文件中讨论了草铵膦在植物中的代谢,其结论与JMPR一致。
在葡萄、苹果、马铃薯、非转基因玉米、小麦等作物的生长过程中,以控制杂草为目的施用草铵膦后,MPP是最主要的残留物。MPP是苹果中唯一检出的残留物;在马铃薯中则占总放射性残留量(total radioactive residues,TRR)的90%,在玉米饲料(maize fodder,类似青贮饲料)中占TRR的60%,在小麦和小麦秸秆中占TRR的30%,在麦壳中占TRR的73%~96%。
草铵膦作为干燥剂/脱叶剂被施用到马铃薯植株上后,由于其能迅速杀死作物,因此在马铃薯中难以检测到草铵膦及其代谢物,而在马铃薯叶中草铵膦是最主要的残留物,占TRR的90%~94%。施用在非转基因油菜上后,草铵膦是油菜籽、油菜籽壳、油菜茎和油菜叶最主要的残留成分,占比超过TRR的90%。
转基因玉米能够将具有生物活性的草铵膦L-对映异构体代谢为NAG。玉米穗的可提取残留占TRR的33%~44%、9%~20%和2%;玉米秸秆饲料中残留物NAG、MPP和草铵膦则分别占TRR的52%~54%、10%~12%和10%~12%。
1.1.3 美国
2002年,美国EPA分析并总结了其1990年、1996年和1999年3份评估报告中关于草铵膦在转基因和非转基因作物上的代谢研究情况。
1990年,EPA评估了草铵膦在非转基因玉米、大豆、苹果、生菜上的代谢试验数据,发现MPP是非转基因作物上唯一的代谢产物。1996年和1999年EPA评估了草铵膦在转基因玉米、大豆、甜菜和油菜中的代谢试验数据,发现转基因作物中的主要残留物包括了草铵膦、NAG和MPP,占TRR的40%~98%,且其中在转基因作物上残留的草铵膦都是草铵膦的D-对映异构体,而L-草铵膦大多降解成了NAG。
综上,草铵膦在常规作物上的主要残留物为母体与MPP,而在转基因作物中则NAG成为了主要残留物。
草铵膦在常规植物和转基因植物中的代谢途径见图1。
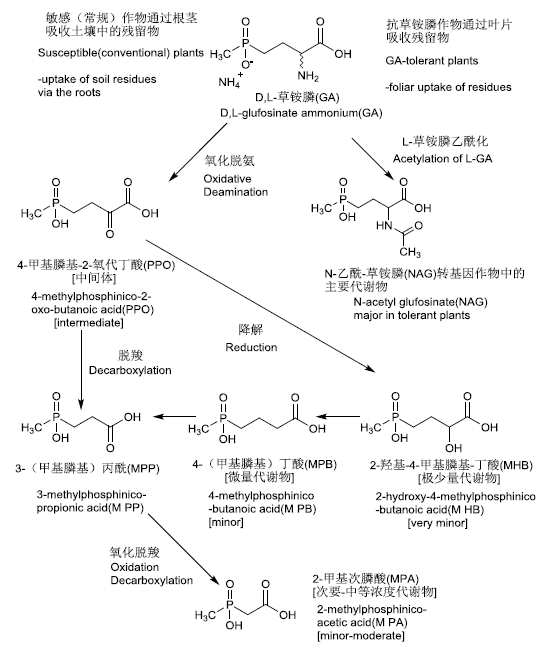
图1 草铵膦在常规作物和耐草铵膦转基因作物中的代谢途径
Fig.1 Metabolism of glufosinate in conventional and tolerant plants
1.2 动物中的代谢
可用作动物饲料的作物在施用草铵膦后,能检测出明显的草铵膦残留,因此有必要了解草铵膦进入动物体内后的代谢归趋。
1.2.1 JMPR
1998年,JMPR对草铵膦及NAG在动物(大鼠、山羊、母鸡)体内的代谢进行了评估,发现大部分草铵膦和NAG通过饲喂进入动物体内后,会迅速被排泄至体外。值得注意的是,NAG在动物体内会逆向转化成草铵膦。饲喂试验表明,未排泄掉的草铵膦和NAG会在动物体内进一步代谢形成MPP,这3个化合物是草铵膦在动物源食品中最主要的残留物。此外,在部分动物源食品中,MPP还会进一步代谢形成2-甲基次膦酸(2-methylphosphinicoacetic acid,MPA)。
大鼠经口饲喂草铵膦后,48 h内雄鼠体内75%的草铵膦通过粪便、8%的草铵膦通过尿液排出体外,雌鼠体内89%的草铵膦通过粪便、11%的草铵膦通过尿液排出体外。山羊经口饲喂草铵膦后,69%的草铵膦通过粪便、2.9%的草铵膦通过尿液被排出体外。山羊经口饲喂NAG后,主要通过粪便、尿液等途径排出体外,但在肝脏、肾脏和奶中仍可检出草铵膦、NAG和MPP残留。
1.2.2 欧盟
2005年,EFSA认为,所有的研究均表明草铵膦在动物体内的任何部位均不蓄积,可迅速被代谢和排泄掉,在所有动物组织和产品中检测到的浓度均低于给药浓度的0.2%。
1.2.3 美国
2002年,EPA认为,饲喂草铵膦处理后,在山羊和母鸡肌肉和脂肪中未检出任何残留物,但在山羊的肝脏、肾脏、奶,在母鸡的蛋和肝脏中,草铵膦和MPA可占到残留物TRR的36%~90%,且在山羊和母鸡中均可检测到NAG,但NAG的残留量通常低于5%TRR。
综上,草铵膦、NAG在动物体内均能被迅速排泄和代谢,不会出现蓄积,且NAG在动物体内还能逆向转化为草铵膦。
草铵膦在动物体内的代谢途径见图2。
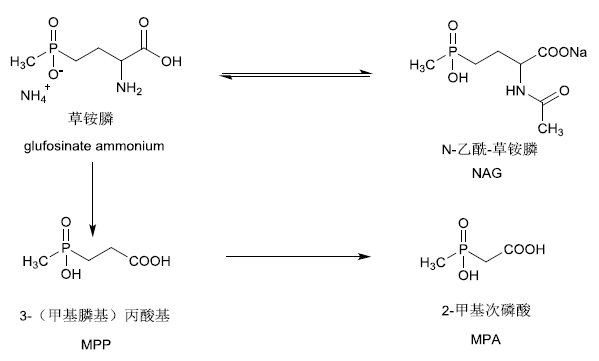
图2 草铵膦在反刍动物和家禽体内可能的代谢途径
Fig. 2 Proposed metabolic pathways of glufosinate in ruminants and poultry
1.3 残留分析方法
早期建立的检测草铵膦及其代谢物残留方法为:样品经纯水提取,提取液浓缩后在乙酸环境中与原乙酸三甲酯发生衍生化反应,衍生物经硅胶纯化后通过GC-FPD或LC-MS/MS进行测定。由于在上述衍生化过程中,草铵膦和NAG会产生相同的衍生物,因此草铵膦和 NAG 通常被合并测定,但如果在衍生化之前通过阳离子交换净化,将草铵膦和NAG分离后再进行衍生化反应,则可分别测定两者的残留量。上述方法经过相应的条件优化,可用于植物源和动物源食品中草铵膦的残留检测,JMPR、美国和日本均对上述方法进行了多次评估,认为此类方法具有良好的适用性和较低的定量限(limit of quantification,LOQ)。
衍生化途径见图3。
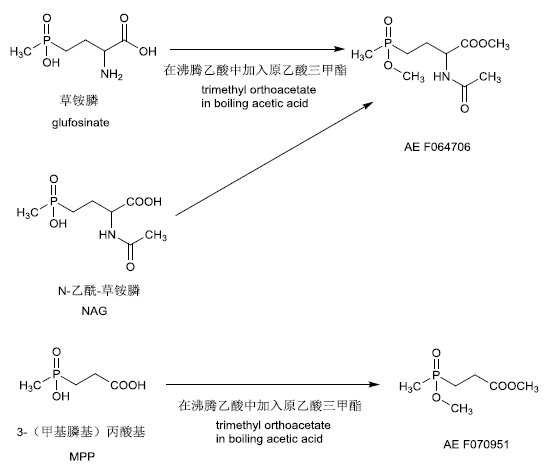
图3 草铵膦及其代谢物残留检测的衍生化反应途径
Fig.3 Derivatization for the detection of glufosinate and metabolites
新的检测方法能使草铵膦衍生成适合液相色谱-串联质谱检测的衍生化产物:当反应体系中存在硼酸钠时,使用邻苯二甲酸二醛和巯基丙酸的混合物对草铵膦进行衍生,衍生化产物通过LC-MS/MS进行定量。代谢物MPP和NAG则可通过LC-MS/MS直接测定,无需按之前的方法进行衍生化处理。
EFSA曾采用DFG S651方法(GC-FPD测定,LC-MS/MS确证)检测草铵膦的残留量。该方法更适用于高含水和高酸性基质中草铵膦和MPP的残留量检测,对于高脂肪含量基质和干燥基质,其LOQ会偏高。但暂无该方法在高酸性、高脂肪含量和干燥基质中检测NAG残留的验证数据。GC-FPD在检测动物源食品基质中草铵膦及代谢物残留时效果不佳,草铵膦、MPP和NAG在鸡蛋和脂肪中的LOQ为0.05mg/kg,在肾脏和肝脏中的LOQ为0.1mg/kg,在牛奶和肉类中的回收率都低于70%。而采用LC-MS/MS检测,则草铵膦在植物源和动物源基质中的定量限均可达到0.01 mg/kg的较低水平。综上,早期草铵膦及其代谢物的检测方法需要增加额外的分离、净化步骤,操作较为繁琐。新的LC-MS/MS检测方法不仅可以单独检测草铵膦及其代谢物,同时还具有更高的适用性和更低的定量限。
1.4 储藏稳定性
总体而言,在低于-20℃的冷冻储存条件下,草铵膦、MPP和NAG在不同基质样品中均具有良好的储藏稳定性。
针对苹果、玉米、大豆、蓝莓、橙子等非转基因作物的研究表明,样本冷冻储存12~24个月后,草铵膦和MPP依然具有较高的回收率,在76%~101%之间。蓝莓样品冷冻储藏约20个月后,再将其提取液分别冷冻储藏78 d和71 d后进行检测,草铵膦和MPP的回收率仍可分别达到95%~98%和72%~73%。
关于玉米、大豆、油菜籽、甜菜等转基因作物及其加工农产品的研究表明,草铵膦、NAG和MPP除在甜菜加工农产品上仅有9个月的稳定储藏数据之外,在其他作物上均至少可稳定储藏12~30个月。值得关注的是,在部分大豆粗粉和外壳样品上,由于酶的作用,草铵膦转化成了NAG,因此部分试验中样品储藏稳定性测定数据以草铵膦及NAG之和表示。
在鸡蛋、鸡肉、牛奶、牛肉等动物源性食品中,草铵膦、NAG和MPP可稳定储藏14~15个月以上。
1.5 残留定义
1.5.1 JMPR
1991年和1994年,评估草铵膦残留定义时由于尚未涉及转基因作物,JMPR推荐其残留定义为“草铵膦与3-(甲基膦基)丙酸(MPP)的总和,以草铵膦表示”。
1998年,JMPR第1次针对转基因作物进行了评估,发现在转基因作物中NAG成为了草铵膦主要的代谢产物。基于此,JMPR推荐调整草铵膦残留定义为“草铵膦、3-(甲基膦基)丙酸 (MPP)、N-乙酰基-草铵膦 (NAG) 之和,以草铵膦表示”。
1999年,JMPR进一步确认上述残留定义可同时用于监管最大残留限量和进行膳食风险评估。
2012年,JMPR分析了草铵膦在3种使用场景下的主要残留物,并认为此前的残留定义涵盖了草铵膦使用的各类场景和主要残留物,不需要再进行修订。
1.5.2 欧盟
EFSA将草铵膦残留定义设定为“草铵膦、3-(甲基膦基)丙酸、N-乙酰基-草铵膦之和,以草铵膦表示”,但其同时认为,对于非转基因作物而言,残留定义“草铵膦与3-(甲基膦基)丙酸之和,以草铵膦表示”也可以接受。
1.5.3 美国
美国EPA制定植物源性和动物源性食品上用于监管草铵膦MRL和膳食风险评估的残留定义均为“草铵膦、3-(甲基膦基)丙酸、N-乙酰基-草铵膦之和,以草铵膦表示”。与此同时,美国也制定了草铵膦在大麦干草、小麦干草等14种饲料上的残留限量,其用于监管MRL的残留定义为“草铵膦与3-(甲基膦基)丙酸之和,以草铵膦表示”。
1.5.4 日本
对于谷物、豆类、坚果和甜菜,PAFSC制定的草铵膦用于监管MRL的残留定义为“草铵膦、3-(甲基膦基)丙酸、N-乙酰基-草铵膦之和,以草铵膦表示”;而对于其他植物源性食品与动物源性食品,日本用于监管MRL的残留定义为“草铵膦与3-(甲基膦基)丙酸之和,以草铵膦表示”。对于膳食风险评估,其残留定义确定为“草铵膦、3-(甲基膦基)丙酸、N-乙酰基-草铵膦之和,以草铵膦表示”。
综上,尽管草铵膦在大量非转基因作物上使用后未检测到NAG残留,但各国家和地区仍倾向于将非转基因作物和转基因作物中草铵膦的残留定义进行统一,即同时包含草铵膦、NAG和MPP。
1.6 残留量计算方法
JMPR推荐的草铵膦残留定义为“草铵膦、3-(甲基膦基)丙酸、N-乙酰基-草铵膦之和,以草铵膦表示”,因此JMPR认为,草铵膦监测定义的总残留量应为“草铵膦+MPP+NAG”,但当某个残留物出现残留量<LOQ的情况时,则总残留量不直接相加,具体计算方法详见表1。
表1 JMPR推荐的草铵膦监测定义残留量计算方式示例
Table 1 The method of JMPR for calculating total residues for glufosinate monitoring definition
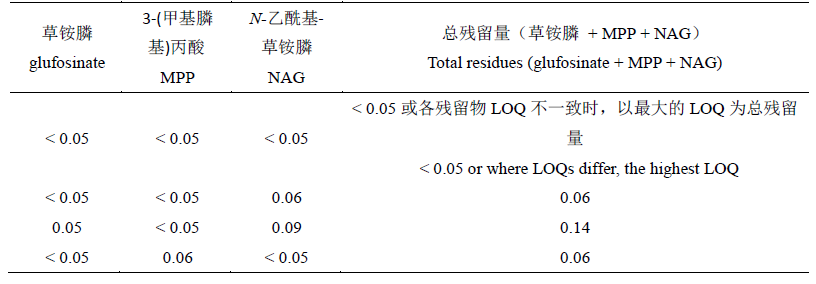
2013年,JMPR曾认为,当时对MPP、NAG和MPA的毒性评估过于保守,因此在估算草铵膦的膳食风险评估残留水平时引入了0.1的系数,将风险评估定义残留量计算方式修订为“总残留量=草铵膦+0.1×(MPP+NAG+MPA)”,并建议在此后启用该新公式计算草铵膦总残留量。但在2014年的评估中,JMPR并未完全按照2013年的推荐,而是将草铵膦风险评估定义残留量的计算方式进一步修订为“总残留量=草铵膦+0.1×(MPP+NAG)”。
EFSA和美国EPA则认为,当某个残留物的残留量<LOQ时,应将其LOQ值加入总残留量,但EPA在描述总残留量时,会在总残留量前增加“<”,以表示该残留量加和时,存在某个残留物<LOQ的情况。
1.7 规范残留试验
1.7.1 JMPR
JMPR评估草铵膦规范残留试验数据时更倾向于将转基因和非转基因作物分成单独的数据组进行评估。
JMPR于1994年、1998年、2012年和2014年分别评估了草铵膦在大豆上的残留数据。1994年,JMPR评估了草铵膦用于非转基因大豆上杂草控制的残留试验数据,56个试验采收间隔期均超过100 d,未检测到草铵膦,仅在5个试验样品中检测出了代谢物MPP。1998年,JMPR首次评估了转基因大豆上的草铵膦残留试验数据,施药两次,采收间隔期62~102 d,最高残留值(highest residue,HR)为1.88 mg/kg。JMPR于2012年和2014年两次评估了美国大豆上草铵膦的残留情况,按照登记的良好农业规范(good agricultural practice,GAP),分别于播种前或出苗前施用1次,出苗后至开花初期再施用1次,或仅在出苗后至开花初期施用,安全间隔期(pre-harvest interval,PHI)70 d。结果表明,2012年和2014年规范试验残留中值(supervised trials median residue,STMR)分别为0.825 mg/kg和0.32 mg/kg,HR值分别为1.9 mg/kg和1.3 mg/kg,结合毒理学数据开展膳食风险评估后,最终推荐草铵膦在大豆上使用的MRL为2 mg/kg。
JMPR分别于1994年、1998年和2012年3次评估了草铵膦在玉米上的残留数据。1994年,JMPR评估了来自奥地利、巴西和德国的非转基因玉米上草铵膦的残留试验数据,在播种时施药1次,或在播种时和播种后株高30~50 cm时施药2次,收获期玉米中仅有1个样品检出了草铵膦,残留量为0.07 mg/kg,且全部样品均未检出代谢物MPP(< 0.05 mg/kg)。1998年JMPR对加拿大、葡萄牙、意大利、西班牙、德国、法国及美国开展的共计106个草铵膦在转基因玉米上的残留试验结果进行评估后表明,100个试验中未检出草铵膦(包括代谢物)残留(<0.05 mg/kg),2个试验中草铵膦的残留量为0.05 mg/kg,4个试验中草铵膦残留量为0.07 mg/kg。2012年,JMPR再次评估了草铵膦在美国转基因玉米上的残留数据,STMR值为0.05 mg/kg,HR值仍为0.07 mg/kg。据此,最终JMPR推荐草铵膦在玉米上的MRL值为0.1mg/kg。
1994年,JMPR评估了非转基因油菜上的草铵膦残留试验数据,得到油菜籽中草铵膦的残留量为<0.2~4.2 mg/kg,据此推荐草铵膦在油菜籽上的MRL值为5 mg/kg。1998年和1999年,JMPR 2次评估了草铵膦在加拿大转基因油菜上的残留试验数据,HR值为0.24 mg/kg。2012年,JMPR评估了德国(PHI 14 d)和英国(PHI 7 d)的非转基因油菜以及美国转基因油菜上的草铵膦残留试验数据,但认为5个转基因作物试验过少,不足以评估草铵膦在转基因油菜上的最大残留水平,因此决定使用非转基因作物试验的结果进行评估,即STMR值为0.225 mg/kg,HR值为0.76 mg/kg,并以此推荐草铵膦在油菜籽上的MRL值为1.5 mg/kg,取代了之前推荐的MRL标准5 mg/kg。
1994年,JMPR还评估了草铵膦在德国非转基因甜菜上的残留试验数据,发现在所有甜菜样品中,草铵膦及其代谢物的残留量均低于LOQ(<0.05 mg/kg)。2012年,美国转基因甜菜上草铵膦的残留试验数据表明,在播种前或苗前施药,亦或在苗后至10叶期(PHI为60 d)施药情况下,STMR值为0.28 mg/kg,HR值为0.67 mg/kg,据此推荐草铵膦在甜菜上的MRL值为1.5 mg/kg,取代了之前推荐的0.05 mg/kg。
JMPR于2012年评估了草铵膦在美国转基因棉花上的残留数据,在播种前或苗前施药1次,苗后至开花初期再施药1次,或只在苗后至开花初期施药1次,PHI为 70 d,STMR值为0.705 mg/kg,HR值为3.2 mg/kg,以此推荐草铵膦在棉籽上的MRL值为5 mg/kg。
1.7.2 欧盟
EFSA关于大豆、油菜、甜菜、棉花等转基因作物上草铵膦残留的风险评估数据均来源于JMPR,但其玉米采纳了在欧洲北部开展的6个非转基因玉米残留试验数据。结果表明,在高于批准施药剂量下,无论是按照风险评估残留定义还是MRL监测残留定义计算,其总残留量均<0.1 mg/kg。依据上述残留数据,EFSA推荐了草铵膦在玉米上的MRL值为0.1 mg/kg。
1.7.3 美国
1999年,美国EPA评估了草铵膦在转基因油菜上的残留数据,发现在0.9~1.3倍施药剂量下,草铵膦的残留量为<0.15~<0.336 mg/kg,据此推荐草铵膦在油菜中的MRL标准为0.4 mg/kg。对于转基因甜菜,在1.1~1.5倍的施药剂量下,甜菜头中草铵膦的残留量为<0.10~1.30 mg/kg,甜菜根中为<0.10~<0.830 mg/kg,因此推荐甜菜头中草铵膦的MRL值为1.5 mg/kg,甜菜根中MRL值为0.9 mg/kg。
1.7.4 日本
由于日本未开展过草铵膦在大豆、玉米、葵花籽、棉籽、油菜籽、甜菜等作物(组)上的规范残留试验,因此PAFSC对这些作物的风险评估数据均来源于JMPR。
通过分析上述评估可知,草铵膦在非转基因作物上大多为播种前后施药,安全间隔期长,代谢物仅有MPP,残留量均较低;在转基因作物上使用时则会出现施药次数增加、施药时期延后、采收间隔期缩短以及产生了新的代谢物(NAG)等情况。因此,草铵膦在转基因的大豆、玉米、甜菜等作物上使用时出现了更高的残留水平。
1.8 规范残留试验
JMPR曾先后对草铵膦在非转基因油菜籽以及转基因玉米、大豆和甜菜上的加工残留数据进行评估,结果表明:草铵膦在各油料作物(玉米、大豆、油菜籽)加工得到食用油的过程中,加工因子(processing factor,PF)均<1;草铵膦在甜菜加工成甜菜糖蜜过程中的加工因子为5.63或6.4,具有浓缩效应,并根据甜菜中的HR值(0.67 mg/kg)和加工因子,推荐草铵膦在甜菜糖蜜中的MRL值为8 mg/kg。此外,尽管菜籽毛油中未检测到草铵膦与MPP的残留量,JMPR依然推荐0.05 mg/kg作为草铵膦在菜籽毛油中的MRL值。
EFSA未就农产品加工过程对草铵膦残留的影响进行评估。尽管瑞典曾评估了几种加工商品中草铵膦的残留量,但由于草铵膦在欧盟并未被批准使用,因此2015年EFSA在评估时也未考虑瑞典的这些数据。
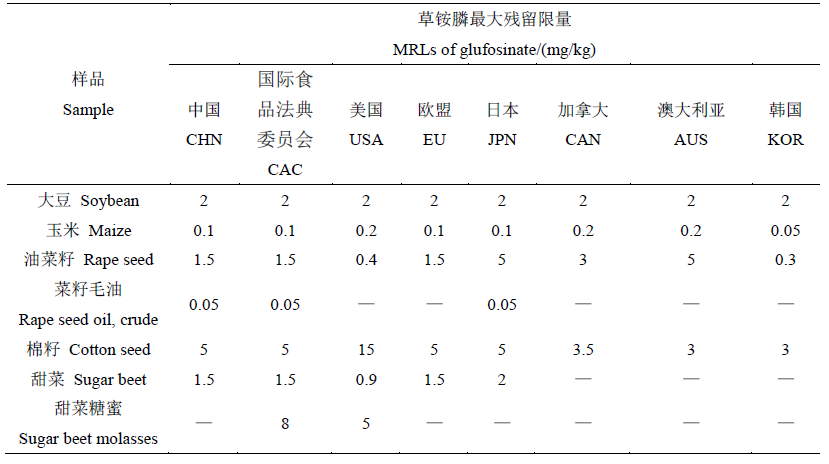
1.9 草铵膦在转基因作物上的残留限量对比
目前,商品化的转基因作物主要有大豆、玉米、油菜、棉花、甜菜等,不同国家和地区制定的草铵膦在上述作物中的MRL标准存在差异(表2),而用于限量标准制定的残留试验数据不同是导致MRL值出现差异的主要原因。
表2 草铵膦在不同国家和地区转基因作物上的残留限量对比
Table 2 Comparison of MRL of glufosinate on transgenic plants by country and region
1.10 草铵膦在动物源性食品中的残留
2012年,JMPR对草铵膦的动物饲喂试验进行了评估。
JMPR认为,潜在的牛饲料包括大豆壳、棉籽压榨副产物、甜菜糖浆、棉籽粉、玉米饲料/草料、大豆粉、大豆、马铃薯秆、玉米碎片、稻草等;可能的家禽饲料包括大豆壳、棉籽粉、玉米饲料/草料、大豆粉、大豆、马铃薯秆、米粒/米粉、米糠/棉籽、豆类种子、玉米粒等。其中大豆、棉籽、甜菜、玉米等作物均可能存在转基因的情况。
给奶牛饲喂含草铵膦和MPP(折算为草铵膦有效成分剂量分别为4、12和40 mg/kg,以下同)的饲料后,牛奶中均未检出残留物,但在最高饲喂剂量(40 mg/kg)下,牛的肝脏、肾脏及脂肪中分别检出了10.7、7.5和0.16 mg/kg的残留量。将不同浓度的草铵膦和NAG添加到奶牛饲料中,最高饲喂浓度组(99.1 mg/kg)奶牛的肝脏、肾脏和牛奶中均检测到了草铵膦或代谢物,其总残留量分别为0.13、0.29和0.07mg/kg。
在母鸡饲料中添加草铵膦和MPP,在最高剂量组(45 mg/kg)的鸡蛋中检测到了0.07 mg/kg的草铵膦残留量;而在母鸡饲料中添加不同剂量(0.44、1.31、4.4 mg/kg)草铵膦和NAG后,所有剂量组的鸡蛋、肝脏、肾脏、脂肪和肌肉样品中草铵膦残留量均低于LOQ。
根据上述饲喂试验结果,计算动物的膳食负荷,JMPR最终推荐草铵膦在生乳、除海洋哺乳动物外的哺乳动物肉类、哺乳动物内脏、禽肉类、禽内脏、蛋类等动物源性食品中的MRL标准分别为0.02、0.05、3、0.05、0.1和0.05 mg/kg。
2005年,EFSA的家禽饲喂研究表明,蛋类或家禽组织中不太可能出现可定量的草铵膦残留物;奶牛饲喂研究表明,肉类、牛奶和脂肪中也不太可能出现可定量的草铵膦残留物,在奶牛肝脏和肾脏中,代谢物MPP的残留量可分别达到1和2 mg/kg,但当暴露期结束后,这些残留物也会迅速减少到低于LOQ。
总之,在饲喂含草铵膦及其代谢物的饲料后,部分动物组织中能检测出一定浓度的残留物,但当暴露期结束后,残留物均可减低到LOQ之下,尚不存在需要关注的残留风险。
2 草铵膦的毒理学评估
2.1 JMPR
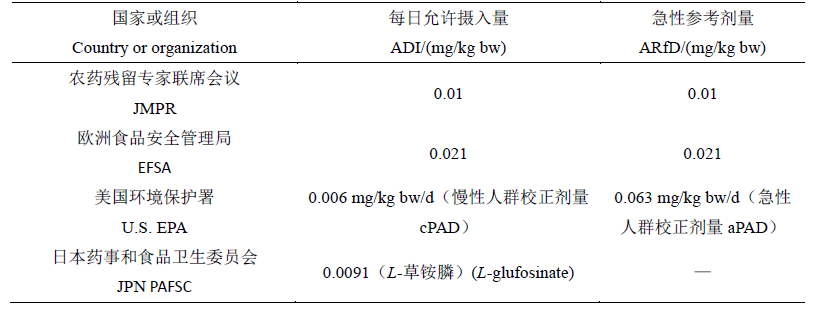
1991年,JMPR第1次评估了草铵膦的毒理学数据,并推荐其每日允许摄入量(acceptable daily intake,ADI)值为0.02mg/kg bw。
2012年,JMPR进一步对草铵膦及代谢物NAG、MPP及MPA进行了毒理学评估,将草铵膦的ADI值与急性参考剂量(acute reference dose,ARfD)值修订为0.01mg/kg bw,且同时将此ADI值与ARfD值应用于代谢物NAG、MPP及MPA。尽管在2013年和2014年的评估报告中,JMPR认为之前对上述3个代谢物的毒理学评估过于保守,因此在草铵膦的膳食风险评估计算时加入了一定的安全系数,但JMPR并未进一步明确适用于NAG、MPP及MPA的ADI值。
2.2 欧盟
EFSA的评估表明,代谢物NAG和MPP的毒性与母体草铵膦相当或更低,并且认为草铵膦的毒理学评价已经涵盖了代谢物的毒理学评价,因此对草铵膦、NAG和MPP建立了一致的ADI值为0.024 mg/kg bw/d。
生殖毒性和神经毒性是草铵膦毒理学试验的关注点。EFSA评估了草铵膦在狗、大鼠和小鼠上的亚慢性和慢性毒性试验数据,在计算ADI时,考虑了大鼠两代繁殖毒性试验中的“未观察到效应水平(no-observed-effect level,NOEL)”,雄性大鼠和雌性大鼠的NOEL值分别为2.4和3.2 mg/kg bw/d,在此剂量水平下,虽然观察到大鼠肾脏质量的增加,但认为这属于草铵膦处理后的非不良效应。不确定系数(uncertainty factor,UF)采用100,从而得出草铵膦对大鼠的ADI值为0.024 mg/kg bw/d。2005年,EFSA在重新评估草铵膦的ADI值时,认为兔子发育毒性研究中的“未观察到不良作用水平(no-observed-adverse-effect level,NOAEL)”为6.3 mg/kg bw/d,综合考虑大鼠与兔子的毒理学数据,增加3倍的额外安全系数(additional safety factor),从而得出草铵膦的ADI值为6.3 mg/kg bw/d/300,即0.021 mg/kg bw/d 。
草铵膦暴露的毒理学试验中,除了在大鼠和兔子中观察到生殖毒性外,在狗、大鼠和兔子中还观察到了其神经毒性。因此,EFSA认为,应将基于生殖毒性或神经毒性研究获得的NOAEL结果用于草铵膦的ARfD评估。在草铵膦对兔子的发育毒性研究中,20 mg/kg bw/d剂量下,出现了早产、流产和死胎等现象,且该剂量水平下怀孕母兔还出现了食物摄入减少、体重增加以及肾脏重量增加等情形,基于上述结果,EFSA设定草铵膦的NOAEL值为6.3 mg/kg bw/d。该NOAEL值被假定涵盖了在其他物种中观察到的神经毒性现象,不确定系数采用100,考虑到危害的严重程度,EFSA还引入了额外评估系数(assessment factor),并将该额外评估系数定为3。根据设定的NOAEL值为6.3 mg/kg bw/d,并推荐放大系数为300(3×100),计算得草铵膦的ARfD值为 0.021 mg/kg bw/d。
2.3 美国
2008年和2012年,EPA对草铵膦的毒理学效应进行了评估,根据针对大鼠、兔子和狗的3项研究中发现的谷氨酰胺合成酶抑制作用和狗心电图的改变,采用“证据权重”方法确定了草铵膦的NOAEL值为6.0 mg/kg/d,通过设定1,000倍的不确定系数(10倍的数据不确定系数,100倍的种间/种内不确定系数),得到其慢性参考剂量(chronic reference dose,cRFD)为0.006 mg/kg/d。由于此处的校正系数为1,因此确定草铵膦的“慢性人群校正剂量(chronic population adjusted dose,cPAD)”与cRFD值相同,均为0.006 mg/kg/d。
同时EPA发现,当草铵膦的“观察到不良作用的最低剂量(lowest-observed-adverse-effect level,LOAEL)”为20 mg/kg时,胎儿出现体重下降和死亡率增加现象,进而EPA确定草铵膦的NOAEL值为6.3 mg/kg,并通过设定1,000倍的不确定系数(10倍的数据不确定系数,100倍的种间/种内不确定系数),得到ARfD值为0.0063 mg/kg /day。由于此处的校正系数为1,因此EPA确定草铵膦的ARfD值与其“急性人群校正剂量(acute population adjusted dose,aPAD)”均为0.063 mg/kg/d。
2.4 日本
2015年,PAFSC认为,由于草铵膦作为农药使用的有效成分是其L-异构体,且从毒性试验分析推断,草铵膦在动物体内的毒性表现也主要是由其L-异构体导致的。因此,PAFSC决定专门针对对毒性更强的L-异构体草铵膦进行综合评价,最终确定草铵膦的ADI值为0.0091 mg/kg bw。
综上所述,目前相关国家和国际组织对草铵膦的毒理学研究已经较为完善,但对其NOAEL值、不确定系数、评估对象(草铵膦或其L-异构体)等存在不同的观点,最终导致了所推荐的草铵膦ADI值与ARfD值存在一定差异。
尽管JMPR在2013年和2014年的评估报告中认为,当时的评估过高估计了草铵膦代谢物NAG、MPP及MPA的毒性,但总体而言,对于NAG、MPP及MPA,上述国家和组织的认识基本一致,即认为3个代谢物的毒性均低于母体,因此不需要针对代谢物单独制定ADI与ARfD。
表3 不同国家和组织制定的草铵膦ADI与ARfD对比
Table 3 Comparison of glufosinate ADI and ARfD by country and organization
3 草铵膦的膳食风险评估
3.1 JMPR
2012年,JMPR报告显示,草铵膦在13个“全球环境监测系统/食品污染监测与评估计划(Global Environment Monitoring System/Food Contamination Monitoring and Assessment Program,GEMS/Food)”膳食分组中的国际每日估算摄入量(international estimated daily intake,IEDI)约占其ADI值的6%~10%,因此认为其长期膳食摄入不会产生不可接受的健康风险。在短期膳食摄入风险评估时,虽然草铵膦在香蕉、猕猴桃、莴苣、大豆和牛肝中的国际估计短期摄入量(international estimated short-term intake,IESTI)分别达到了其ARfD值的110%、110%、180%、120%和170%,但JMPR认为,在香蕉、猕猴桃、莴苣和牛肝中,代谢物MPP是主要残留物,在大豆上MPP也占到了残留量的15%,而MPP的毒性远低于母体草铵膦,因此草铵膦的短期膳食摄入同样也不会产生不可接受的健康风险。
3.2 欧盟
2015年,EFSA将国际食品法典委员会(CAC)制定的MRL标准纳入草铵膦的膳食风险评估中,发现JMPR在短期膳食风险评估时采用了甜菜的STMR值,而不是HR值。考虑到甜菜成为商品需要经过工业化加工,故采用STMR值而不是HR值进行计算是可以接受的,因此EFSA也认可JMPR所采用的方式,在其评估甜菜中草铵膦的短期膳食摄入风险时也采用了STMR值。
EFSA的评估结果显示,草铵膦对英国幼儿的长期膳食摄入风险最高,长期膳食摄入量占ADI值的37%,其中大白菜的短期膳食摄入风险最高,摄入大白菜导致的短期膳食摄入量占ARfD的88%。
3.3 美国
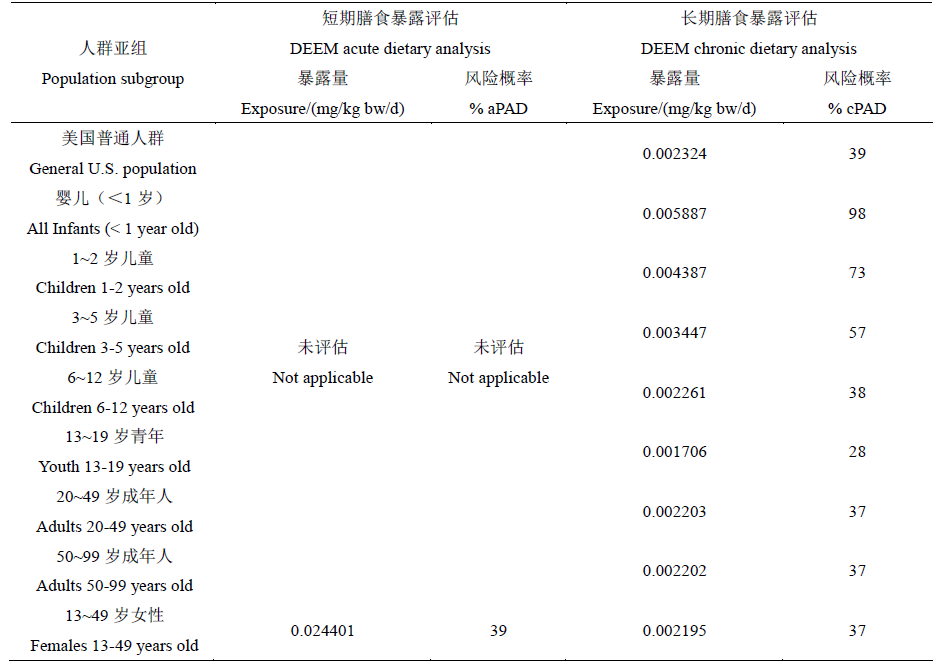
2012年,EPA利用“基于食品摄入量数据库的膳食暴露评估模型(Dietary Exposure Evaluation Model software with the Food Commodity Intake Database,DEEM-FCID™,Version 3.10)”对草铵膦的膳食摄入风险进行了评估。结果显示:在针对13~49岁女性亚组的评估中,由于其短期摄入量只占aPAD值的39%,因此不需要关注其短期膳食摄入风险;同时,草铵膦的长期膳食摄入风险也低于EPA健康影响处(Health Effects Division,HED)的关注标准(<100% cPAD),其中,全体人群的长期膳食摄入量占cPAD 的39%,亚组中最大的风险出现在婴儿组,婴儿的长期膳食摄入量占cPAD 的98%(表4),但也仍然<100% cPAD。
表4 美国EPA对草铵膦残留的膳食暴露风险评估结果
Table 4 Results of the U.S. EPA's dietary exposure risk assessment for glufosinate ammonium residues
3.4 日本
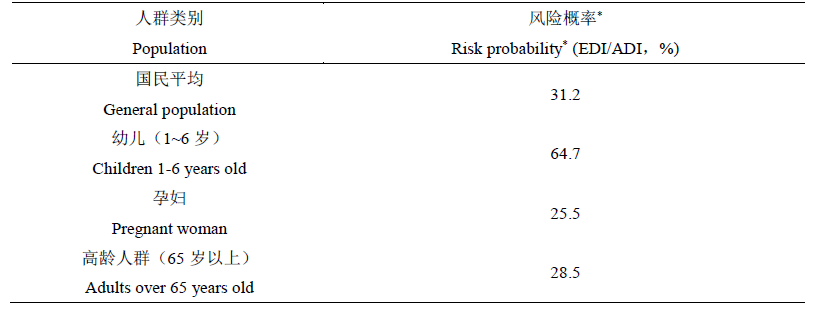
结合日本国内的试验结果,PAFSC对草铵膦的膳食暴露风险进行了评估,结果(表5)表明,草铵膦对各类人群的风险概率介于25.5%~64.7%之间,故认为目前草铵膦的使用不会对日本国民健康产生不可接受的风险。
表5 日本药事和食品卫生委员会对草铵膦残留的膳食暴露风险评估结果
Table 5 Results of the Japan PAFSC's dietary exposure risk assessment for glufosinate ammonium residues
* 注:个别作物采用估计每日摄入量(estimated daily intake,EDI)进行计算,其余作物采用理论每日最大摄入量(theoretical maximum daily intake,TMDI)进行计算,其中EDI=根据作物残留检测结果估算的残留量×每种食物的平均摄入量,TMDI= 拟定限量值×每种食物的平均摄入量。
* Note: Individual crops were calculated using EDI and the rest were calculated using TMD, where EDI=residue level estimated from crop residue test×average intake per food, and TMDI=proposed limit value×average intake per food.
4 小结与建议
现有研究表明,草铵膦在转基因作物上使用后产生了新的主要代谢物NAG,目前国际上已将其与草铵膦母体、非转基因作物中的主要代谢物MPP一同纳入了草铵膦的残留定义中。与非转基因作物相比,由于施药次数增加、施药时期延后以及新代谢物出现等原因,草铵膦在转基因作物上表现出了更高的残留水平,但总体而言,转基因作物上草铵膦的膳食风险评估也尚未出现需要特别关注的风险。JMPR、欧盟、美国和日本在制定草铵膦的MRL标准时也还没有区分转基因和非转基因作物。目前国际上在开展草铵膦在转基因作物上残留的膳食风险评估时,对试验数据要求、评估技术规范、MRL值推荐方法等均与非转基因作物基本相同。
我国已建立了较为完善的农药登记管理残留风险评估技术体系,现行的试验准则、标准和规范可基本满足我国开展草铵膦在转基因作物上残留登记评价的需求,但针对具体评估方法,特提出以下建议:
(1)由于农药在转基因作物上的代谢途径往往与非转基因作物存在差异,因此国内开展农药在转基因作物上的残留风险评估研究时,建议先开展必要的代谢试验,确认是否有新的代谢途径和代谢物产生,以确保后续试验研究的完整性和科学性。
(2)在膳食摄入风险评估过程中,建议遵循风险最大化原则,合理选取残留试验数据,不能仅选取农药在转基因或非转基因作物上的残留数据,必要时应综合使用转基因和非转基因作物的残留数据。
(3)建议对转基因和非转基因作物制定统一、合理的残留定义和MRL标准,以提高监管效率,有效保障农产品质量安全。
(4)不同类型的基因转入作物后,可能会导致农药在该作物上的代谢、残留等产生新变化,因此农药产品在申请登记时,首先需标明所登记作物是否为转基因作物,如为转基因作物还应注明其转基因的类型。当某种作物出现新型的转基因方案和商品,农药登记在该新型转基因作物上时,应按照农药登记资料要求重新开展符合登记试验准则要求的试验,并开展新的膳食风险评估。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的版权属于原作者,若有侵权,请联系删除。